��Ŀ����
(10��)���£�N2H4���ֳ���������һ�ֿ�ȼ�Ե�Һ�壬���������ȼ�ϡ���֪��101kPaʱ��32.0gN2H4����������ȫȼ�����ɵ������ų�����624kJ��25��ʱ����N2H4��ȫȼ�շ�Ӧ���Ȼ�ѧ����ʽ�� ��������������
���¡�����ȼ�ϵ����һ�ּ���ȼ�ϵ�أ��������Һ��20%��30%��KOH��Һ���¡�����ȼ�ϵ�طŵ�ʱ�������ĵ缫��Ӧʽ�� ����
�����ĵ缫��Ӧʽ�� ����������������
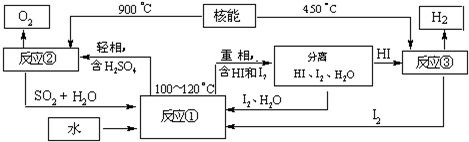
����ͼ��һ���绯ѧ����ʾ��ͼ��
�� пƬ�Ϸ����ĵ缫��Ӧ�� ���� ��
�ڼ���ʹ���¡�����ȼ�ϵ����Ϊ�������еĵ�Դ��ͭƬ��������
��128g������һ����ȼ�ϵ�����������ı�״���µĿ��� L
����������������������Ϊ20%��
�ȴ�ͳ�Ʊ��µķ���������NaClO����NH3���Ƶ��µ�ϡ��Һ���÷�
Ӧ�����ӷ���ʽ������������������������������������������������
��N2H4(1)+O2(g)=N2(g)+2H2O��1������H=��624kJ/mol(2��)
��O2+2H2O+4e��=4OH�� (1��) N2H4+4OH����4e��=4H2O+N2��(1��)
�Ǣ�Cu2++2e��=Cu (2��) ��112(2��) ��ClO-+2NH3=N2H4+Cl-+H2O(2��)
����:��

(10��)���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á���ش��������⣺
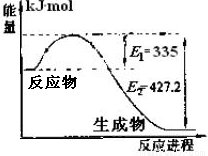
��1����ͼ��N2��H2��Ӧ����2molNH3�����������仯ʾ��ͼ�������ÿ����1molNH3�ų�����Ϊ ��
��2���ڹ̶�������ܱ������У��������»�ѧ��Ӧ��N2(g)+3H2(g)2NH3(g)���仯ѧƽ�ⳣ��K��t�Ĺ�ϵ���±���
| t/K | 298 | 398 | 498 | ���� |
| K/(mol��L��1)��2 | 4.1��106 | K1 | K2 | ���� |
������������⣺
���ԱȽ�K1��K2�Ĵ�С��K1 K2����д��>����=����<����
�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬�����ݵ��� ���������ĸ����
����A��������N2��H2��NH3��Ũ��֮��Ϊ1��3��2����B��2v(N2)(��)= v(H2)(��)
����C��������ѹǿ���ֲ��� ����D�����������ܶȱ��ֲ���
��3�������£�N2H6Cl2����һ����Ҫ�Ļ���ԭ�ϣ��������ӻ����������ˮ����Һ�����ԣ�ˮ��ԭ����NH4Cl���ơ�
����д�������µ�һ��ˮ�ⷴӦ�����ӷ���ʽ ��
����������ˮ��Һ������Ũ�ȵĹ�ϵ��ʾ��ȷ���� ������ţ���
����A��c(Cl��)>c(N2H62+)>c(H+)>c(OH��)
����B��c(Cl��)>c([N2H5��H2O]+)>c(OH��)>c(H+)
����C��2c(N2H62+)+c([N2H5��H2O]+)+ c(H+) =c(Cl��)+c(OH��)
����D��c(N2H62+) > c(Cl��)> c(H+)>c(OH��)
(10��)���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á���ش��������⣺
��1����ͼ��N2��H2��Ӧ����2molNH3�����������仯ʾ��ͼ�������ÿ����1molNH3�ų�����Ϊ ��
��2���ڹ̶�������ܱ������У��������»�ѧ��Ӧ��N2(g)+3H2(g)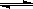 2NH3(g)���仯ѧƽ�ⳣ��K��t�Ĺ�ϵ���±���
2NH3(g)���仯ѧƽ�ⳣ��K��t�Ĺ�ϵ���±���
|
t/K |
298 |
398 |
498 |
���� |
|
K/(mol��L��1)��2 |
4.1��106 |
K1 |
K2 |
���� |
������������⣺
���ԱȽ�K1��K2�Ĵ�С��K1 K2����д��>����=����<����
�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬�����ݵ��� ���������ĸ����
����A��������N2��H2��NH3��Ũ��֮��Ϊ1��3��2����B��2v(N2)(��)= v(H2)(��)
����C��������ѹǿ���ֲ��� ����D�����������ܶȱ��ֲ���
��3�������£�N2H6Cl2����һ����Ҫ�Ļ���ԭ�ϣ��������ӻ����������ˮ����Һ�����ԣ�ˮ��ԭ����NH4Cl���ơ�
����д�������µ�һ��ˮ�ⷴӦ�����ӷ���ʽ ��
����������ˮ��Һ������Ũ�ȵĹ�ϵ��ʾ��ȷ���� ������ţ���
����A��c(Cl��)>c(N2H62+)>c(H+)>c(OH��)
����B��c(Cl��)>c([N2H5��H2O]+)>c(OH��)>c(H+)
����C��2c(N2H62+)+c([N2H5��H2O]+)+ c(H+) = c(Cl��)+c(OH��)
����D��c(N2H62+) > c(Cl��)> c(H+) >c(OH��)