题目内容
【题目】如图为某市售盐酸试剂瓶上的部分数据:

(1)该市售盐酸的物质的量浓度为_________mol/L。(计算结果精确到小数点后1位,下同)
(2)欲配制1mol/L盐酸溶液475mL,则需量取该市售盐酸_____mL,除烧杯、量筒、胶头滴管外,还需用到的玻璃仪器是________;下列情况会使所配溶液浓度偏高的是______(填序号)
A.量筒使用前用未干燥
B.用量筒量取浓盐酸时,俯视刻度线
C.量取出的浓盐酸露置较长时间后才加水稀释
D.洗涤量取浓盐酸的量筒,并将洗涤液转移到容量瓶中
(3)浓度均为1mol/L的盐酸与氢氧化钡溶液等体积混合后OH-的物质的量浓度=___________mol/L(忽略溶液体积变化);质量分数分别为36.5%和13.5%的盐酸等体积混合,所得溶液的质量分数__________25%(填“>”“<”或“=”);在标准状况下,1体积水吸收__________体积的HCl气体可制得36.5%的盐酸(水的密度以1.00g/cm3计)。
【答案】11.8 42.4 玻璃棒和500mL容量瓶 D 0.5 > 352.8
【解析】
(1)根据c=1000ρw/M计算;
(2)依据稀释定律计算;根据配制一定物质的量浓度的步骤确定需用到的玻璃仪器;根据n=cV判断溶液中溶质的物质的量和溶液体积变化,进行误差分析;
(3)依据酸、碱的元次和化学方程式进行过量判断;盐酸浓度越大,溶液密度越大;依据c=n/V计算。
(1)根据c=1000ρw/M,密度为1.18g/mL、质量分数为36.5%的浓盐酸的物质的量为:(1000×1.18×36.5%)/36.5mol/L=11.8mol/L,故答案为:11.8 mol/L;
(2)①实验室应该用500ml容量瓶配制475mL1mol/L盐酸溶液,设需要浓盐酸的体积为VL,由稀释定律可得:VL×11.8mol/L=0.5L×1mol/L,解得V=0.0424L=42.4ml,故需要量取浓盐酸42.4ml,故答案为42.4ml;
②配制475mL1mol/L稀盐酸时使用的仪器除烧杯、量筒、胶头滴管外,还必须用到玻璃棒、500mL容量瓶,故答案为:玻璃棒、500mL容量瓶;
③A项、量筒使用前用未干燥,量取的浓盐酸体积偏小,溶质的物质的量偏小,导致所配溶液浓度偏低,故A错误;
B项、定容时仰视容量瓶刻度线,所配溶液体积偏大,导致所配溶液浓度偏低,故B错误;
C项、量取出的浓盐酸露置较长时间,浓盐酸挥发,溶质物质的量减小,配制的标准液浓度减小,故C错误;
D项、量筒使用错误,使用量同时不需要洗涤量筒,若洗涤量筒并将洗涤液倒入烧杯,相当多量取盐酸,n值偏高,c偏高,故D正确;
故答案为:D;
(3)①浓度均为1mol/L的盐酸与氢氧化钡溶液等体积混合,氢氧化钡过量,设溶液的体积为VL,则溶液中c(OH—)=(1mol/L×VL×2—1mol/L×VL)/2VL=0.5 mol/L,故答案为:0.5 mol/L;
②盐酸浓度越大,溶液密度越大,设溶液的体积为Vml,质量分数分别为36.5%和13.5%的盐酸等体积混合,所得溶液的质量分数(36.5%×V d1+13.5%×V d2)/(V d1+V d2)= 13.5%+23% d1/( d1+Vd2) >13.5%+23%×1/2=25%,故答案为:>;
③设水的体积为1L,HCl的体积为xL,则HCl的物质的量为x/22.4mol,HCl的质量为36.5x/22.4 g,1L水的质量为1000mL×1g/mL=1000g,则有(1000g+36.5x/22.4 g)×36.5%=36.5x/22.4 g,解得x=352.8g,故答案为:352.8。

 名校课堂系列答案
名校课堂系列答案【题目】将牛奶和姜汁混合,待牛奶凝固便成为一种富有广东特色的甜品——姜撞奶。为了掌握牛奶凝固所需的条件,某同学在不同温度的等量牛奶中混人一些新鲜姜汁,观察混合物15min,看其是否会凝固,结果如下表。请回答下列问题:
温度(℃) | 20 | 40 | 60 | 80 | 100 |
结果 | 15min后仍未有凝固迹象 | 14min内完全凝固 | 1min内完全凝固 | 1min内完全凝固 | 15min后仍未有凝固迹象 |
(注:用曾煮沸的姜汁重复这项实验,牛奶在任何温度下均不能凝固)
(1)实验证明新鲜姜汁中含有一种酶,其作用是 。
(2)20℃和100℃时,15min后仍未有凝固迹象,说明酶的活性较低,其原因分别是 和 。
(3)若60℃时牛奶在有姜汁和没有姜汁的情况下都可以凝固,当反应进行到t时,向其中加人姜汁。下图中能正确表示加姜汁后牛奶凝固随时间变化趋势的曲线是 。
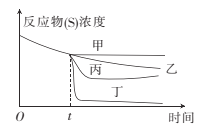
(4)为提高实验的准确度,实验中“不同温度的等量牛奶中混入一些新鲜姜汁”操作中应注意的是 。
(5)有同学说,该实验不能得出姜汁使牛奶凝固的最适温度,请提出解决方案: 。