题目内容
12.含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料--光导纤维,C与烧碱反应生成含A元素的化合物D.(1)在元素周期表中,A位于第ⅣA族,与A同族但相对原子质量比A小的元素B的原子结构示意图为
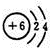 ,A与B在原子的电子层结构上的相同点是最外层均有4个电子.
,A与B在原子的电子层结构上的相同点是最外层均有4个电子.(2)易与C发生化学反应的酸是氢氟酸,反应的化学方程式是SiO2+4HF═SiF4↑+2H2O.
(3)将C与纯碱混合高温熔融时发生化学反应生成D,同时还生成B的最高价氧化物E;将少量的E通入D的水溶液中,生成含A的化合物F.
①分别写出生成D和F的化学反应方程式:SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑、Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓
②要将纯碱高温熔化,下列坩埚中不可选用的是AB
A.普通玻璃坩埚 B.石英玻璃坩埚 C.铁坩埚
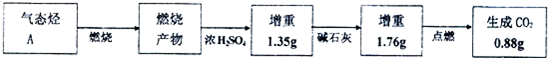
(4)100g C与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2L,100g混合物中石灰石的质量分数是50%.
分析 含A元素的一种单质是一种重要的半导体材料,则A为Si,含A元素的一种化合物C可用于制造高性能的现代通讯材料--光导纤维,则C为SiO2,C与烧碱反应生成含A元素的化合物D为Na2SiO3,
(1)A的最外层电子数为4,B元素的原子最外层电子数与Si相同,二者最外层电子数相同,相对原子质量比A小的元素B为C元素;
(2)二氧化硅与氢氟酸反应生成四氟化硅与水;
(3)①将SiO2与纯碱混合高温熔融时反应生成Na2SiO3,同时还生成B的最高价氧化物E,则E为CO2,B为C,将全部的CO2与全部的Na2SiO3在足量的水中混合后,生成了含A的化合物F为H2SiO3;
②普通玻璃坩埚、石英玻璃坩埚、瓷坩埚中的二氧化硅高温下都能与碳酸钠反应;
(4)发生SiO2+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑,气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,以此计算.
解答 解:含A元素的一种单质是一种重要的半导体材料,则A为Si,含A元素的一种化合物C可用于制造高性能的现代通讯材料--光导纤维,则C为SiO2,C与烧碱反应生成含A元素的化合物D为Na2SiO3,
(1)A的最外层电子数为4,位于第ⅣA族,与A同族但相对原子质量比A小的元素B为C,其原子结构示意图为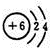 ,二者最外层均有4个电子,
,二者最外层均有4个电子,
故答案为:ⅣA;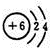 ;最外层均有4个电子;
;最外层均有4个电子;
(2)二氧化硅与氢氟酸反应生成四氟化硅与水,反应方程式为:SiO2+4HF═SiF4↑+2H2O,
故答案为:氢氟酸;SiO2+4HF═SiF4↑+2H2O;
(3)①将SiO2与纯碱混合高温熔融时反应生成Na2SiO3,同时还生成B的最高价氧化物E,则E为CO2,B为C,反应为SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑;将全部的CO2与全部的Na2SiO3在足量的水中混合后,生成了含A的化合物F为H2SiO3,反应方程式为Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓,
故答案为:SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑、Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓;
②普通玻璃坩埚、石英玻璃坩埚中的二氧化硅在高温下都能与碳酸钠反应,应在铁坩埚中熔融,故答案为:AB;
(4)气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,由SiO2+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑、CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑可知,碳酸钙的质量为0.5mol×100g/mol=50g,则100g混合物中石灰石的质量分数是$\frac{50g}{100g}$×100%=50%,
故答案为:50%.
点评 本题考查无机物的推断,为高频考点,涉及硅及其化合物性质、转化及化学用语的考查,侧重分析与推断、计算能力的考查,综合性较强,题目难度不大.

 始祖鸟烯(Pterodactyladiene),形状宛如一只展翅飞翔的鸟,其键线式(线表示C-C键,端点、交点表示碳原子)如图,其中R1、R2为烷烃基.则下列有关始祖鸟烯的说法中正确的是( )
始祖鸟烯(Pterodactyladiene),形状宛如一只展翅飞翔的鸟,其键线式(线表示C-C键,端点、交点表示碳原子)如图,其中R1、R2为烷烃基.则下列有关始祖鸟烯的说法中正确的是( )| A. | 始祖鸟烯与乙烯互为同系物 | |
| B. | 若R1=R2=-CH3,则其化学式为C12H16 | |
| C. | 始祖鸟烯既能使酸性高锰酸钾褪色也能使溴水褪色,其褪色原理是一样的 | |
| D. | 若R1=R2,一定条件下烯烃双键碳原子上的氢也能取代,则始祖鸟烯环上的二氯代物有10种 |
| A. | 2-甲基-3-丁烯 | B. | 4-甲基-3-乙基已烷 | ||
| C. | 4-甲基-3-戊醇 | D. | 2,3,3-三甲基戊烷 |
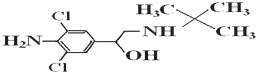
| A. | 摩尔质量为313.5g | |
| B. | 属于芳香烃类化合物 | |
| C. | 瘦肉精的分子式为C12H17Cl2N2O | |
| D. | 可发生加成反应、取代反应、消去反应 |
| A. | 在周期表中,元素的族序数都等于其原子的最外层电子数 | |
| B. | 周期表中非金属性最强的元素,其最高价氧化物的水化物酸性也最强 | |
| C. | 同主族元素随原子核电荷数的递增,原子半径依次减小 | |
| D. | 第ⅦA族元素的单质,随分子量的增大,熔、沸点逐渐升高 |
| A. | 乳酸:CH3-CH(OH)-COOH | |
| B. | 甘油:CH2(OH)-CH(OH)-CH2(OH) | |
| C. | 脱氧核糖:CH2(OH)-CH(OH)-CH(OH)-CH2-CHO | |
| D. | 核糖:CH2(OH)-CH(OH)-CH(OH)-CH(OH)-CHO |
| A. | 治理“地沟油”,可通过水解反应制得肥皂 | |
| B. | 硅晶体具有半导体性能,可用于制取光导纤维 | |
| C. | 人类超量碳排放及氮氧化物和二氧化硫的排放是形成酸雨的主要原因 | |
| D. | PM2.5是指空气中直径≤2.5 μm的颗粒物,直径为2.5 μm的颗粒物分散在空气中形成胶体(1μm=10-6m) |
| A. | 对太阳光进行光谱分析,可证明太阳上是否含有Ar元素 | |
| B. | 利用焰色反应鉴别NaCl和KCl两种溶液 | |
| C. | 利用石灰水鉴别纯碱和小苏打两种溶液 | |
| D. | 利用烧碱溶液鉴别MgCl2和AlCl3两种溶液 |
 .
.