题目内容
取体积相同(0.025 L)的两份0.10 mol·L-1 NaOH溶液,把其中一份放在空气中一段时间后,溶液的pH______(填“增大”“减小”或“不变”),其原因是______。用已知浓度的硫酸溶液中和上述两份溶液,若中和第一份(在空气中放置一段时间)所消耗硫酸溶液的体积为V(A),另一份消耗硫酸溶液的体积为V(B),则:①以甲基橙(已知甲基橙pH变色范围为3.1—4.4)为指示剂时,V(A)与V(B)的关系是______;②以酚酞为指示剂时,V(A)与V(B)的关系是______。
减小 NaOH与空气中CO2反应 V(A)=V(B) V(A)<V(B)
解析:NaOH溶液放置于空气中,因NaOH与空气中CO2反应,使NaOH减小,故溶液的pH减小。
用H2SO4滴定Na2CO3溶液,反应分两个阶段进行:
a.H++![]() ====
====![]() (此时溶液呈弱碱性);
(此时溶液呈弱碱性);
b.H++![]() ====CO2↑+H2O(溶液呈弱酸性)。
====CO2↑+H2O(溶液呈弱酸性)。
滴定过程按哪种反应进行,取决于选择的指示剂。①若选用甲基橙作指示剂,因其变色范围在pH=3.1—4.4,滴定反应按b进行,由关系式2NaOH![]() Na2CO3
Na2CO3![]() CO2↑知,消耗的H2SO4的量不变,故答案为V(A)=V(B)。②若选用酚酞作指示剂,酚酞的变色范围为pH=8—10,滴定反应按a进行,消耗H2SO4的量减小,故答案为V(A)<V(B)。
CO2↑知,消耗的H2SO4的量不变,故答案为V(A)=V(B)。②若选用酚酞作指示剂,酚酞的变色范围为pH=8—10,滴定反应按a进行,消耗H2SO4的量减小,故答案为V(A)<V(B)。

练习册系列答案
相关题目
|
室温时取浓度相同的NaOH和HCl溶液,以2∶1体积比相混合,所得溶液的pH等于12,则原溶液的浓度为 | |
| [ ] | |
A. |
0.05 mol/L |
B. |
0.03 mol/L |
C. |
0.02 mol/L |
D. |
0.50 mol/L |
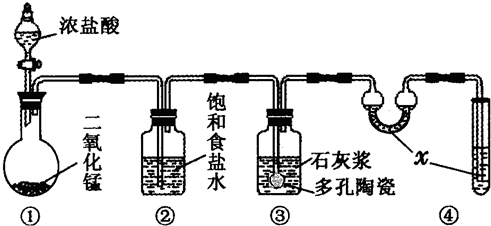
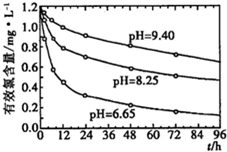
 科学家研究发现,进入生物体内的氧分子,可接受1个电子转变为超氧阴离子自由基(O2-),进而引发产生一系列自由基。一切需氧生物在其机体内均有一套完整的活性氧系统(抗氧化酶和抗氧化剂),能将活性氧转变为活性较低的物质,机体因此受到保护。人们利用羟胺(NH2OH)氧化的方法可以检测其生物系统中O2-含量,原理是O2-与羟胺反应生成NO2-和一种过氧化物。NO2-在对氨基苯磺酸和α-萘胺作用下,生成粉红的偶氮染体,染体在波长530nm处有显著吸收,且其吸收值与c(NO2-)成正比,从而可计算出样品中的O2-含量。某实验室用以上方法处理后测得溶液中c(NO2-)=2.500×10-3 mol?L-1。
科学家研究发现,进入生物体内的氧分子,可接受1个电子转变为超氧阴离子自由基(O2-),进而引发产生一系列自由基。一切需氧生物在其机体内均有一套完整的活性氧系统(抗氧化酶和抗氧化剂),能将活性氧转变为活性较低的物质,机体因此受到保护。人们利用羟胺(NH2OH)氧化的方法可以检测其生物系统中O2-含量,原理是O2-与羟胺反应生成NO2-和一种过氧化物。NO2-在对氨基苯磺酸和α-萘胺作用下,生成粉红的偶氮染体,染体在波长530nm处有显著吸收,且其吸收值与c(NO2-)成正比,从而可计算出样品中的O2-含量。某实验室用以上方法处理后测得溶液中c(NO2-)=2.500×10-3 mol?L-1。