题目内容
【题目】在一密闭烧瓶中充满NO2,在25℃时NO2与N2O4达到平衡:2NO2![]() N2O4ΔH﹤0,把烧瓶置于100℃沸水中,又建立新的平衡状态,前后两平衡比较,不变的是
N2O4ΔH﹤0,把烧瓶置于100℃沸水中,又建立新的平衡状态,前后两平衡比较,不变的是
A.颜色B.平均分子量C.物质的量D.密度
【答案】D
【解析】
正反应放热,把烧瓶置于100℃沸水中,升高温度,该反应逆向移动,则
A.由于升高温度,平衡逆向移动,二氧化氮浓度增大,气体的颜色加深,所以前后两平衡气体的颜色不相同,故A不选;
B.反应两边都是气体,气体的总质量不变,升高温度,平衡逆向移动,混合气的物质的量增大,平均分子量减小,所以前后两平衡平均分子量不相同,故B不选;
C.升高温度,平衡逆向移动,混合气体的物质的量增大,所以前后两平衡物质的量不相等,故C不选;
D.反应两边都是气体,气体的总质量不变,烧瓶的容积固定,根据ρ=m/V,气体的密度一定不会变化,故D选;
故答案选D。

 世纪百通期末金卷系列答案
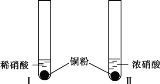
世纪百通期末金卷系列答案【题目】某学习小组探究稀HNO3、浓HNO3与铜的反应。
装置(尾气处理装置略) | 现象 |
| Ⅰ中开始无明显现象,渐有小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色。 |
Ⅱ中反应剧烈,迅速生成大量红棕色气体,溶液呈绿色。 |
(1)试管Ⅰ中Cu与稀HNO3反应的化学方程式是________。
(2)Ⅱ中反应的速率比Ⅰ中的快,原因是________。
(3)针对Ⅱ中溶液呈绿色的原因,提出假设:
假设1:Cu2+的浓度较大所致;
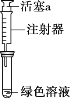
假设2:溶解了生成的NO2。
探究如下:取Ⅱ中绿色溶液,分为两等份。
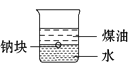
①取一份于如图所示装置中,_______(填“操作”和“现象”),证实Ⅱ中溶解了NO2。
②向另一份溶液加入_____(填化学试剂),溶液变为蓝色。证实假设1不成立,假设2成立。
(4)对于稀HNO3与铜生成NO、浓HNO3与铜生成NO2的原因,提出两种解释:
解释1.HNO3浓度越稀,溶液中NO3-的数目越少,被还原时,每个NO3-从还原剂处获得较多电子的机会_____(填“增多”或“减少”),因此被还原为更低价态。
解释2.推测下列平衡导致了产物的不同,并通过如下实验证实了推测的合理性。
3NO2+H2O=2HNO3+NO
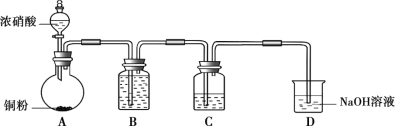
①B中盛放的试剂是________。
②C中盛放Cu(NO3)2和_________。
③该小组证实推测的合理性所依据的实验现象是________。