题目内容
14.某化工厂的废液中主要含有Al3+、Mg2+、K+、Cl-四种离子,某校化学兴趣小组设计了如图所示的实验过程,以除去废液中含有的Mg2+、K+杂质离子,得到AlCl3溶液并尽可能减少AlCl3的损失.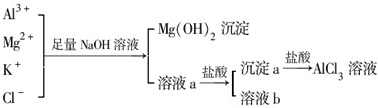
(1)写出混合物中加入足量NaOH溶液时,溶液中发生反应生成最终产物的离子方程式:Mg2++2OH-=Mg(OH)2↓、Al3++4OH-=2H2O+AlO2-.能否用氨水代替NaOH溶液,为什么?否;用氨水,则Mg2+、Al3+均转化为沉淀,不能分离
(2)溶液a中存在的离子有AlO2-、K+、Cl-、Na+、OH-;在溶液a中加入盐酸时需控制溶液的pH,为什么?因氢氧化铝能溶于盐酸,则向溶液a中滴加盐酸需控制溶液的pH;为此,改进方法是通入过量的二氧化碳.
分析 由实验流程可知,加足量的NaOH生成氢氧化镁沉淀,溶液a中含AlO2-、K+、Cl-、Na+、OH-,然后加盐酸,沉淀c为氢氧化铝,和盐酸反应生成氯化铝,溶液b中含KCl、NaCl,
(1)镁离子和氢氧化钠反应生成氢氧化镁沉淀,铝离子和足量的氢氧化钠反应生成偏铝酸钠和水,据此书写离子方程式,氨水和镁离子、铝离子均生成沉淀,无法把二者分开;
(2)根据发生的反应判断a溶液中存在离子,由于氢氧化铝为两性氢氧化物,能溶于强酸,故最佳方案是通入二氧化碳气体,氢氧化铝不溶于二氧化碳溶液中.
解答 解:由实验流程可知,加足量的NaOH生成氢氧化镁沉淀,过滤得到溶液a中含AlO2-、K+、Cl-、Na+、OH-,然后加盐酸,沉淀c为氢氧化铝,加盐酸生成氯化铝,溶液b中含KCl、NaCl;
(1)混合物中镁离子和铝离子和氢氧化钠反应,镁离子生成氢氧化镁沉淀,反应的离子方程式为:Mg2++2OH-=Mg(OH)2↓,铝离子和足量的氢氧化钠反应生成偏铝酸钠和水,反应的离子方程式为:Al3++4OH-=2H2O+AlO2-,用氨水,则Mg2+、Al3+均转化为沉淀,不能分离,则不能用氨水代替NaOH,
故答案为:Mg2++2OH-=Mg(OH)2↓;Al3++4OH-=2H2O+AlO2-;否;用氨水,则Mg2+、Al3+均转化为沉淀,不能分离;
(2)Al3+与过量NaOH反应,溶液a中含AlO2-、K+、Cl-、Na+、OH-,向溶液a中加入盐酸,生成氢氧化铝沉淀,因氢氧化铝能溶于盐酸,则向溶液a中滴加盐酸需控制溶液的pH,向溶液a中加入试剂X的最佳方案是通入过量的二氧化碳生成氢氧化铝沉淀和碳酸氢钠,过滤得到氢氧化铝固体,反应的离子方程式为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-、K+、Cl-、Na+、OH-;因氢氧化铝能溶于盐酸,则向溶液a中滴加盐酸需控制溶液的pH;通入过量的二氧化碳.
点评 本题考查混合物分离、提纯实验方案的设计,为高频考点,把握实验流程中发生的反应为解答的关键,侧重分析与实验能力的考查,注意氢氧化铝的两性,题目难度不大.

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
| A. | +2(b-a) kJ•mol-1 | B. | +(b+c-a) kJ•mol-1 | ||
| C. | +(a+b) kJ•mol-1 | D. | +2(a-b-c) kJ•mol-1 |
| A. | Cu2++2OH-═Cu(OH)2CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | Ba2++SO${\;}_{4}^{2-}$═BaSO4↓ Ba(OH)2+H2SO4═BaSO4↓+2H2O | |
| C. | Ag++Cl-═AgCl↓ AgNO3+NaCl═AgCl↓+NaNO3 | |
| D. | Cu+2Ag+═Cu2++2Ag↓ Cu+2AgCl═2Ag+CuCl2 |
| A. | 常温常压下,11.2 L氧气所含的氧原子数为NA | |
| B. | 1 mol/L的CaCl2溶液中含有的Cl-为2 NA | |
| C. | 2.4 g镁变成Mg2+时失去的电子数目为0.2 NA | |
| D. | 标准状况下,2 g氢气所含的原子数目为NA |
| A. | 全球增温问题,臭氧空洞问题,酸雨问题 | |
| B. | 海洋污染问题,土壤荒漠化问题,物种灭绝 | |
| C. | 森林面积减少,饮用水污染问题,有害废弃物越境迁移 | |
| D. | 饮用水污染问题,土壤荒漠化问题,噪声污染问题 |
| A. | v(N2O5)=1.8×10-4 mol/(L•s) | B. | v(N2O5)=1.08×10-2 mol/(L•s) | ||
| C. | v(NO2)=1.8×104 mol/(L•s) | D. | v(O2)=1.8×104 mol/(L•s) |
| A. | $\frac{11.2bc}{a{N}_{A}}$ L | B. | $\frac{11.2ab}{c{N}_{A}}$L | C. | $\frac{11.2ac}{b{N}_{A}}$ L | D. | $\frac{11.2b}{ac{N}_{A}}$L |
| A. | 铜片 | B. | 硫酸溶液 | C. | 熔融的氯化钠 | D. | 固体氯化钾 |