题目内容
【题目】若NA表示阿伏加德罗常数,下列说法正确的是
A.0.1 mol 氦气所含有的原子数为0.2NA
B.标准状况下,22.4 L水中含有的氧原子数为NA
C.1 mol H2的质量只有在标准状况下才约为2 g
D.18g H2O和NA 个OH—中含有的电子数均为10 NA
【答案】D
【解析】
试题分析:A.稀有气体是单原子分子,0.1 mol氦气所含有的原子数为0.1NA,A错误;B.标准状况下水是液体,不能利用气体摩尔体积计算物质的量,B错误;C.1 mol H2的质量在都是2 g,C错误;D.18g H2O是1mol,NA 个OH—是1mol,其中含有的电子数都为10 NA,D正确,答案选D。

 优生乐园系列答案
优生乐园系列答案【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外接电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:
铅蓄电池:Pb(s)+PbO2(s)+2H2SO4(aq)==2PbSO4(s)+2H2O(l);
电解池:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下各组判断正确的是( )
铅蓄电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
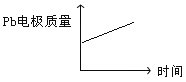
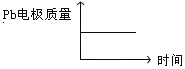
D |
|
|
A. A B. B C. C D. D
【题目】下列方法中,不能用于实验室制取氨的是
A. 在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热
B. 加热试管中的氯化铵固体
C. 将烧瓶中的浓氨水加热
D. 将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中
【题目】某同学取不同质量的镁铝合金样品分别与30 mL同浓度的盐酸反应,所取合金质量与产生气体体积(已转化为标准状况)如下:
实验序号 | a | b | c |
合金质量/mg | 510 | 765 | 918 |
气体体积/mL | 560 | 672 | 672 |
通过计算求:
(1)该盐酸的物质的量浓度
(2)合金中镁的质量分数
(3)在c组实验后,还需向容器中加入多少毫升同浓度的盐酸才能使剩余合金恰好完全溶解?