题目内容
(14分)H2O2的水溶液是一种常用的杀菌剂,其质量百分比一般为3%和30%。
1-1 在H2O2作用下可实现Fe(CN)63-与Fe(CN)64-之间的相互转化,在酸性溶液中H2O2可使Fe(CN)64-转化为Fe(CN)63-;在碱性溶液里H2O2可使Fe(CN)63-转化为Fe(CN)64-。写出以上相互转化的离子方程式 。
1-2 分别写出实验室、老工业、新工业制备H2O2的三种方法。
1-3 写出二种定量测定H2O2水溶液中H2O2含量的化学方程式和简要实验步骤。
1-4 将H2O2溶液滴入含有酚酞的NaOH溶液中,红色消失。甲学生认为这是由于H2O2是二元弱酸,消耗了OH-,而使红色褪去;乙学生认为,H2O2具有强氧化性,将酚酞氧化,红色消失。试设计一个实验论证甲、乙两位学生的解释中哪种正确?
1-1 酸性溶液中:2Fe(CN)64-+H2O2+2H+=2Fe(CN)63-+2H2O
碱性溶液中:2Fe(CN)63-+H2O2+2OH-=2Fe(CN)64-+2H2O+O2↑(2分)
1-2 实验室:BaO2+2CO2+2H2O=Ba(HCO3)2+H2O2(2分)
老工业:2NH4HSO4![]() (NH4)2S2O8+H2↑
(NH4)2S2O8+H2↑
(NH4)2S2O8+H2O=2NH4HSO4+H2O2 (2分)
新工业: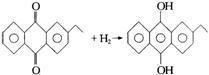
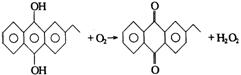 (2分)
(2分)
1-3 ①用标准KMnO4溶液滴定H2O2水溶液:
2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O(2分)
②H2O2水溶液中加入过量KI溶液,再用标准Na2S2O3溶液进行滴定:
H2O2+2I-+2H+=I2+2H2O I2+2S2O32-=2I-+S2O42-(2分)
1-4 向褪色后的溶液中加入少量氢氧化钠溶液使溶液显碱性,如果溶液变红,说明甲学生的解释正确;反之,说明乙学生的解释正确。(2分)

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
 。写出电解硫酸氢铵溶液的阴极和阳极反应工。
。写出电解硫酸氢铵溶液的阴极和阳极反应工。