题目内容
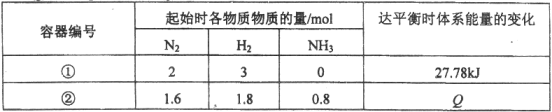
【题目】同温度下,体积均为1L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)![]() 2NH3(g) △H= -92.6 kJ / mol。测得数据如下表:
2NH3(g) △H= -92.6 kJ / mol。测得数据如下表:
下列叙述不正确的是
A.容器②中反应开始时v(正)> v(逆)
B.容器①、②中反应达平衡时压强相等
C.容器②中反应达平衡时,吸收的热量Q为9.26 kJ
D.若条件为“绝热恒容”,容器①中反应达平衡时n (NH3)< 0.6 mol
【答案】A
【解析】
试题分析:A.N2(g)+3H2(g)2NH3(g)△H=-92.6kJ/mol
初始浓度:2 3 0 92.6kJ
变化浓度:1/3 1 2/3 27.78kJ
平衡浓度:5/3 2 2/3
K=0.1,容器(2)中反应开始时,Qc=![]() >K,所以反应逆向移动,v(正)<v(逆),故A错误;B.从等效平衡的角度分析,1.6molN2、1.8molH2和0.8molNH3相当2molN2、3molH2,在相同条件下处于相同平衡状态,所以平衡时两个容器内压强相等,故B正确;C.容器(2)中反应逆向进行达平衡,所以吸收热量,(1)和(2)的平衡常数是一样的,所以容器(2)中反应达平衡时,吸收的热量Q为1/3×27.78kJ=9.26kJ,故C正确D.条件为“绝热恒容”,容器(1)中反应进行中,温度会升高,化学平衡会逆向移动,所以达平衡时n(NH3)<0.6mol,故D正确;故选A。
>K,所以反应逆向移动,v(正)<v(逆),故A错误;B.从等效平衡的角度分析,1.6molN2、1.8molH2和0.8molNH3相当2molN2、3molH2,在相同条件下处于相同平衡状态,所以平衡时两个容器内压强相等,故B正确;C.容器(2)中反应逆向进行达平衡,所以吸收热量,(1)和(2)的平衡常数是一样的,所以容器(2)中反应达平衡时,吸收的热量Q为1/3×27.78kJ=9.26kJ,故C正确D.条件为“绝热恒容”,容器(1)中反应进行中,温度会升高,化学平衡会逆向移动,所以达平衡时n(NH3)<0.6mol,故D正确;故选A。

练习册系列答案
相关题目
