题目内容
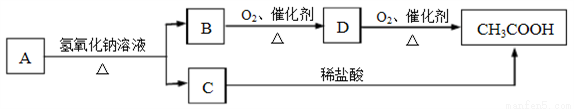
游离态的氮经一系列转化可以得到硝酸,如下图所示。
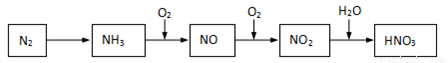
(1)NH3和O2在催化剂作用下反应,其化学方程式是______________。
(2)NO2→HNO3反应中氧化剂和还原剂的物质的量之比为________________。
(3)2NO(g)+O2(g)  2NO2(g)是制造硝酸的重要反应之一。在800℃时,向容积为1L的密闭容器中充入0.010molNO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。
2NO2(g)是制造硝酸的重要反应之一。在800℃时,向容积为1L的密闭容器中充入0.010molNO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。
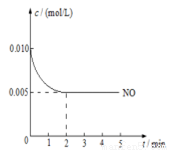
①2min内,v(O2)=________mol/(L·min)
②800℃时,该反应的化学平衡常数为__________。
③判断该反应达到平衡的依据是(写出2条即可)____________。
④已知:ⅰ.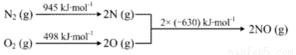
ⅱ.N2(g)+2O2(g)=2NO2(g) ΔH=+68kJ·mol-1,写出NO生成NO2热化学方程式_____________,温度对于NO生成NO2平衡转化率的影响是:___________________。
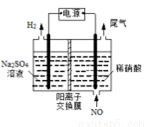
(4)电解法处理含氮氧化物废气,可以回收硝酸。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极)。请写出电极过程中NO转化为硝酸的电极反应式:______________。
在一定条件下,苯与氯气在氯化铁催化下连续反应,生成以氯苯、氯化氢为主要产物,邻二氯苯、对二氯苯为次要产物的粗氯代苯混合物。有关物质的沸点如下:
氯苯 | 邻二氯苯 | 对二氯苯 | |
沸点/℃ | 132.2 | 180.5 | 174 |
熔点/℃ | -45.6 | -15 | 53 |
下列说法正确的是
A. 该反应属于取代反应
B. 反应放出的氯化氢可以用水吸收
C. 用蒸馏的方法可将邻二氯苯从有机混合物中首先分离出来
D. 该反应必须在密闭体系中进行
(Ⅰ)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)=CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________________。
(2)某温度下,平衡浓度符合下式: c(CO2)·c(H2)= c(CO)·c(H2O),试判断此时的温度为______℃。
(Ⅱ)在一定温度下将2molA和2molB两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g)== 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D。B的平衡浓度为________, A的转化率为_______,用D表示的平均反应速率为_____。



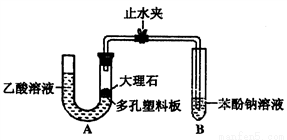
 -ONa溶液的pH, 其pH由大到小排列的顺序为 _______________(填溶液编号)
-ONa溶液的pH, 其pH由大到小排列的顺序为 _______________(填溶液编号)