题目内容
将一定质量的Mg-Al合金投入100 mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5 mol·L-1 NaOH溶液至过量,生成的沉淀质量与加入的NaOH溶液的体积关系如图所示。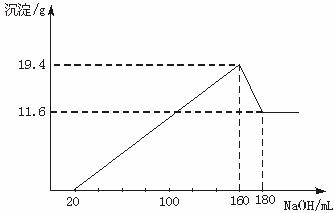
求:(1)原合金中Mg、Al质量各多少克。 (2)HCl物质的量浓度。
解析:由图可知,11.6 g是Mg(OH)2沉淀的质量,(19.4-11.6)g是Al(OH)3的质量,当V(NaOH)=20 mL时,中和HCl,无沉淀生成。
(1)Mg ~ Mg(OH)2
24 58
m(Mg) 11.6 g
m(Mg)=![]() =4.8 g
=4.8 g
Al ~ Al(OH)3
27 78
m(Al) 7.8 g
m(Al)=![]() =2.7 g
=2.7 g
(2)当V(NaOH)=160 mL时,此时Mg2+、Al3+全部以Mg(OH)2、Al(OH)3沉淀的形式存在,则溶液中n(Cl-)=n(Na+)=0.16 L×5 mol·L-1=0.8 mol
所以c(HCl)=![]() =8 mol·L-1
=8 mol·L-1
答案:(1)Mg:4.8 g Al:2.7 g (2)c(HCl)=8 mol·L-1

练习册系列答案
相关题目
将一定质量的Mg、Zn、Al混合物与足量稀H2SO4反应,生成H2 2.24L(标准状况),原混合物的质量可能是( )
| A、1.8g | B、3g | C、6.5g | D、10g |
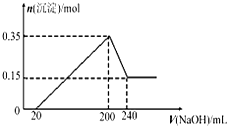 将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示,则下列说法不正确的是( )
将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示,则下列说法不正确的是( )| A、Mg和Al的总质量为9g | B、生成的H2在标准状况下的体积为11.2L | C、NaOH溶液的物质的量浓度为5mol/L | D、硫酸的物质的量浓度为1mol/L |
 (2009?长春一模)将一定质量的Mg和Al的混合物投入1mol?L-1500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )
(2009?长春一模)将一定质量的Mg和Al的混合物投入1mol?L-1500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )