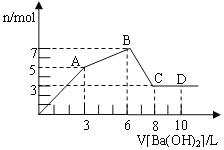
题目内容
【题目】将40g的锌粉和少量浓硫酸在加热条件下充分反应,共收集到混合气体11.2L(标准状况),则剩余锌粉的质量为( )
A. 1.0gB. 2.0gC. 2.5gD. 7.5g
【答案】D
【解析】
Zn与浓硫酸发生反应:Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O,当反应进行到一定程度后变为稀硫酸,这时发生反应:Zn+H2SO4(稀)=ZnSO4+H2↑,反应产生的气体为SO2、H2的混合物。二者的物质的量的和是n(H2)+n(SO2)=11.2L÷22.4L/mol=0.5mol;根据方程式可知反应消耗Zn的物质的量与反应产生的气体的物质的量相等,则反应消耗Zn的物质的量是0.5mol,消耗Zn的质量是m(Zn)=nM=0.5mol×65g/mol=32.5g,所以反应后剩余的Zn的质量是40g-32.5g=7.5g。答案选D。
ZnSO4+SO2↑+2H2O,当反应进行到一定程度后变为稀硫酸,这时发生反应:Zn+H2SO4(稀)=ZnSO4+H2↑,反应产生的气体为SO2、H2的混合物。二者的物质的量的和是n(H2)+n(SO2)=11.2L÷22.4L/mol=0.5mol;根据方程式可知反应消耗Zn的物质的量与反应产生的气体的物质的量相等,则反应消耗Zn的物质的量是0.5mol,消耗Zn的质量是m(Zn)=nM=0.5mol×65g/mol=32.5g,所以反应后剩余的Zn的质量是40g-32.5g=7.5g。答案选D。

练习册系列答案
相关题目
【题目】下列除去杂质(试样中括号内的物质是杂质)时,选用的试剂正确的是( )
A | B | C | D | |
试样 | Na2CO3(NaHCO3) | FeCl2(FeCl3) | Fe(Al) | CO2(SO2) |
除杂试剂 | 澄清石灰水 | NaOH溶液 | NaOH溶液 | 饱和NaHSO3溶液 |
A. AB. BC. CD. D