题目内容
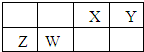 X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如右图所示.Z元素原子核外K层与M层电子数相等.下列说法中正确的( )
X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如右图所示.Z元素原子核外K层与M层电子数相等.下列说法中正确的( )| A、Y元素最高价氧化物对应的水化物化学式为H3YO4 | B、原子半径由小到大的顺序为:X<Z<Y<W | C、与同浓度的盐酸反应,Z比W更剧烈 | D、X的氧化物不能与Z单质反应 |
分析:X、Y、Z、W为四种短周期主族元素,Z元素原子核外K层与M层电子数相等,则Z原子M层电子数为2,故Z为Mg元素,由元素周期表中的相对位置可知,W为Al元素、X为C元素、Y为N元素,据此解答.
解答:解:X、Y、Z、W为四种短周期主族元素,Z元素原子核外K层与M层电子数相等,则Z原子M层电子数为2,故Z为Mg元素,由元素周期表中的相对位置可知,W为Al元素、X为C元素、Y为N元素,
A.Y为N元素,最高价氧化物对应的水化物化学式为HNO3,故A错误;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径N<C<Al<Mg,故B错误;
C.金属性Mg>Al,故与同浓度的盐酸反应,Mg比Al更剧烈,故C正确;
D.Mg在二氧化碳中燃烧生成MgO与碳单质,故D错误,
故选C.
A.Y为N元素,最高价氧化物对应的水化物化学式为HNO3,故A错误;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径N<C<Al<Mg,故B错误;
C.金属性Mg>Al,故与同浓度的盐酸反应,Mg比Al更剧烈,故C正确;
D.Mg在二氧化碳中燃烧生成MgO与碳单质,故D错误,
故选C.
点评:本题考查结构位置性质关系应用,难度不大,注意把握元素周期表的结构、元素周期律的递变规律,D选项为易错点,该知识点推断题中经常考查.

练习册系列答案
相关题目
 NH3?H2O+H+
NH3?H2O+H+ H++HO2-HO2-
H++HO2-HO2- H++O22-
H++O22-