题目内容
(1)质量都为a g的镁和铝,物质的量之比为______;将它们分别放入适量的盐酸溶液中恰好完全反应,则消耗的HCl的物质的量之比为______.(2)在含有35.8g Na2CO3和NaHCO3混合物的溶液中加入200mL 某浓度的盐酸,恰好完全反应,生成8.96L CO2(标准状况).则原溶液中有______mol Na2CO3,盐酸的物质的量浓度为______ mol/L.
(3)已知Cu3P中P为-3价,在反应 11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4 中:
①被氧化的P和被还原的P的物质的量之比为______.
②当有8mol H2O参加反应,上述反应转移的电子数目为______个.
【答案】分析:(1)根据n=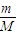 计算金属的物质的量,判断物质的量之比;恰好反应分别生成氯化镁、氯化铝,根据元素守恒可知n(MgCl2)=n(Mg),n(Al)=n(AlCl3),根据氯元素守恒可知,镁消耗的盐酸为n(HCl)=2n(MgCl2),铝消耗的盐酸为n′(HCl)=3n(AlCl3),据此计算.
计算金属的物质的量,判断物质的量之比;恰好反应分别生成氯化镁、氯化铝,根据元素守恒可知n(MgCl2)=n(Mg),n(Al)=n(AlCl3),根据氯元素守恒可知,镁消耗的盐酸为n(HCl)=2n(MgCl2),铝消耗的盐酸为n′(HCl)=3n(AlCl3),据此计算.
(2)令35.8g Na2CO3和NaHCO3混合物中 Na2CO3、NaHCO3的物质的量分别为xmol、ymol,根据质量、生成的二氧化碳体积列方程计算x、y的值,反应后溶液为氯化钠,根据钠元素守恒可知n(NaCl)=2n(Na2CO3)+n(NaHCO3),根据氯元素守恒有n(HCl)=n(NaCl),再根据c= 计算.
计算.
(3)①化合价升高被氧化,化合价降低被还原,根据方程式中P元素的化合价变化,判断被氧化的P和被还原的P的物质的量之比.
②根据水的物质的量计算参加反应的P的物质的量,反应中只有P元素的化合价升高,由0价降低为+5价,起氧化剂作用的P占参加反应的P的 ,据此计算.
,据此计算.
解答:解:(1)n(Mg)= =
= mol,n(Al)=
mol,n(Al)= =
= mol,所以n(Mg):n(Al)=
mol,所以n(Mg):n(Al)= mol:
mol: mol=9:8;
mol=9:8;
根据元素守恒可知n(MgCl2)=n(Mg),n(Al)=n(AlCl3),根据氯元素守恒可知,镁消耗的盐酸为n(HCl)=2n(MgCl2),铝消耗的盐酸为n′(HCl)=3n(AlCl3),所以n(HCl):n′(HCl)=2n(MgCl2):3n(AlCl3)=2× mol:3×
mol:3× mol=3:4.
mol=3:4.
故答案为:9:8;3:4.
(2)生成8.96L CO2(标准状况)的物质的量为 =0.4mol,
=0.4mol,
令35.8g Na2CO3和NaHCO3混合物中 Na2CO3、NaHCO3的物质的量分别为xmol、ymol,则:
 ,解得:x=0.1;y=0.3.
,解得:x=0.1;y=0.3.
所以原溶液中有0.1mol Na2CO3,
反应后溶液为氯化钠,根据钠元素守恒可知n(NaCl)=2n(Na2CO3)+n(NaHCO3)=0.1mol×2+0.3mol=0.5mol,根据氯元素守恒有n(HCl)=n(NaCl)=0.5mol,盐酸的物质的量浓度为 =2.5 mol/L.
=2.5 mol/L.
故答案为:0.1;2.5.
(3)①11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4 中P元素化合价由0价升高为+5价,被氧化,由0价降低为-3价,被还原,根据方程式可知11molP中被氧化的P为6mol,被还原的P为5mol,被氧化的P和被还原的P的物质的量之比为6:5.
故答案为:6:5.
②有8mol H2O参加反应,参加反应的P的物质的量为8mol× =
=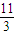 mol,反应中只有P元素的化合价降低,由0价降低为-3价,起氧化剂作用的P占参加反应的P的
mol,反应中只有P元素的化合价降低,由0价降低为-3价,起氧化剂作用的P占参加反应的P的 ,转移电子数为
,转移电子数为 mol×
mol× ×5×NAmol-1=10NA.
×5×NAmol-1=10NA.
故答案为:10NA.
点评:考查根据方程式的计算、常用化学计量的计算、氧化还原反应等,难度不大,注意基础知识的掌握.
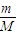 计算金属的物质的量,判断物质的量之比;恰好反应分别生成氯化镁、氯化铝,根据元素守恒可知n(MgCl2)=n(Mg),n(Al)=n(AlCl3),根据氯元素守恒可知,镁消耗的盐酸为n(HCl)=2n(MgCl2),铝消耗的盐酸为n′(HCl)=3n(AlCl3),据此计算.
计算金属的物质的量,判断物质的量之比;恰好反应分别生成氯化镁、氯化铝,根据元素守恒可知n(MgCl2)=n(Mg),n(Al)=n(AlCl3),根据氯元素守恒可知,镁消耗的盐酸为n(HCl)=2n(MgCl2),铝消耗的盐酸为n′(HCl)=3n(AlCl3),据此计算.(2)令35.8g Na2CO3和NaHCO3混合物中 Na2CO3、NaHCO3的物质的量分别为xmol、ymol,根据质量、生成的二氧化碳体积列方程计算x、y的值,反应后溶液为氯化钠,根据钠元素守恒可知n(NaCl)=2n(Na2CO3)+n(NaHCO3),根据氯元素守恒有n(HCl)=n(NaCl),再根据c=
 计算.
计算.(3)①化合价升高被氧化,化合价降低被还原,根据方程式中P元素的化合价变化,判断被氧化的P和被还原的P的物质的量之比.
②根据水的物质的量计算参加反应的P的物质的量,反应中只有P元素的化合价升高,由0价降低为+5价,起氧化剂作用的P占参加反应的P的
 ,据此计算.
,据此计算.解答:解:(1)n(Mg)=
 =
= mol,n(Al)=
mol,n(Al)= =
= mol,所以n(Mg):n(Al)=
mol,所以n(Mg):n(Al)= mol:
mol: mol=9:8;
mol=9:8;根据元素守恒可知n(MgCl2)=n(Mg),n(Al)=n(AlCl3),根据氯元素守恒可知,镁消耗的盐酸为n(HCl)=2n(MgCl2),铝消耗的盐酸为n′(HCl)=3n(AlCl3),所以n(HCl):n′(HCl)=2n(MgCl2):3n(AlCl3)=2×
 mol:3×
mol:3× mol=3:4.
mol=3:4.故答案为:9:8;3:4.
(2)生成8.96L CO2(标准状况)的物质的量为
 =0.4mol,
=0.4mol,令35.8g Na2CO3和NaHCO3混合物中 Na2CO3、NaHCO3的物质的量分别为xmol、ymol,则:
 ,解得:x=0.1;y=0.3.
,解得:x=0.1;y=0.3.所以原溶液中有0.1mol Na2CO3,
反应后溶液为氯化钠,根据钠元素守恒可知n(NaCl)=2n(Na2CO3)+n(NaHCO3)=0.1mol×2+0.3mol=0.5mol,根据氯元素守恒有n(HCl)=n(NaCl)=0.5mol,盐酸的物质的量浓度为
 =2.5 mol/L.
=2.5 mol/L.故答案为:0.1;2.5.
(3)①11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4 中P元素化合价由0价升高为+5价,被氧化,由0价降低为-3价,被还原,根据方程式可知11molP中被氧化的P为6mol,被还原的P为5mol,被氧化的P和被还原的P的物质的量之比为6:5.
故答案为:6:5.
②有8mol H2O参加反应,参加反应的P的物质的量为8mol×
 =
=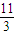 mol,反应中只有P元素的化合价降低,由0价降低为-3价,起氧化剂作用的P占参加反应的P的
mol,反应中只有P元素的化合价降低,由0价降低为-3价,起氧化剂作用的P占参加反应的P的 ,转移电子数为
,转移电子数为 mol×
mol× ×5×NAmol-1=10NA.
×5×NAmol-1=10NA.故答案为:10NA.
点评:考查根据方程式的计算、常用化学计量的计算、氧化还原反应等,难度不大,注意基础知识的掌握.

练习册系列答案
相关题目
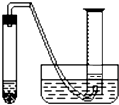 某学生拟通过测定粗锌(杂质与稀硫酸不反应)与稀硫酸反应产生的气体体积,来测定粗锌中锌的纯度.现有粗锌、稀硫酸、试管、镊子、单孔橡皮塞、导气管、托盘天平、量筒、水槽、铁架台(附铁夹)等仪器、药品.
某学生拟通过测定粗锌(杂质与稀硫酸不反应)与稀硫酸反应产生的气体体积,来测定粗锌中锌的纯度.现有粗锌、稀硫酸、试管、镊子、单孔橡皮塞、导气管、托盘天平、量筒、水槽、铁架台(附铁夹)等仪器、药品.