题目内容
常温下,取pH=2的两种二元酸H2A与H2B各1 mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
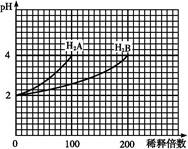
A.H2A为二元弱酸
B.PH=4的NaHA水溶液中离子浓度大小为c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
C.含NaHA、NaHB的混合溶液中,离子浓度大小为c(Na+)=c(A2-)+c(HB-)+c(B2-)
D.Na2B的水溶液中,离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+)

A.H2A为二元弱酸
B.PH=4的NaHA水溶液中离子浓度大小为c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
C.含NaHA、NaHB的混合溶液中,离子浓度大小为c(Na+)=c(A2-)+c(HB-)+c(B2-)
D.Na2B的水溶液中,离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+)
D
根据图像可知:H2A溶液稀释100倍,溶液pH由2增至4,说明H2A是强酸,而H2B溶液稀释200倍,溶液pH增加2个单位,说明H2B是弱酸,A项错误;由于HA- H++A2-,溶液中不存在H2A、HA-,B项错误;由物料守恒关系可知:c(Na+)=c(A2-)+c(HB-)+c(H2B)+c(B2-),C项错误;H2B是弱酸,其钠盐水溶液呈碱性,D项正确。
H++A2-,溶液中不存在H2A、HA-,B项错误;由物料守恒关系可知:c(Na+)=c(A2-)+c(HB-)+c(H2B)+c(B2-),C项错误;H2B是弱酸,其钠盐水溶液呈碱性,D项正确。
 H++A2-,溶液中不存在H2A、HA-,B项错误;由物料守恒关系可知:c(Na+)=c(A2-)+c(HB-)+c(H2B)+c(B2-),C项错误;H2B是弱酸,其钠盐水溶液呈碱性,D项正确。
H++A2-,溶液中不存在H2A、HA-,B项错误;由物料守恒关系可知:c(Na+)=c(A2-)+c(HB-)+c(H2B)+c(B2-),C项错误;H2B是弱酸,其钠盐水溶液呈碱性,D项正确。
练习册系列答案
相关题目




 不变
不变