题目内容
金属元素及其化合物在科学研究和生产生活中有着广泛的用途.
(1)氢气还原氧化铜时,产生的红色物质,冷却后加入稀硫酸发现溶液呈淡蓝色,写出该现象发生的离子方程式 .
(2)铝的某种超原子结构(Al13)具有40个价电子时最稳定.请预测稳定的Al13所带的电荷数为 .取铝合金(含铝90%)1.5g与80mL 3mol?L-1盐酸充分反应(合金中其它成分不参加反应).滤去不溶物,将滤液稀释到100mL,取出稀释液5mL,加入0.6mol?L-1的氨水使Al3+恰好完全沉淀.上述铝合金和盐酸反应的过程中生成氢气 L(标准状况).使Al3+恰好完全沉淀时,消耗氨水 mL.
(1)氢气还原氧化铜时,产生的红色物质,冷却后加入稀硫酸发现溶液呈淡蓝色,写出该现象发生的离子方程式
(2)铝的某种超原子结构(Al13)具有40个价电子时最稳定.请预测稳定的Al13所带的电荷数为
考点:铝的化学性质,铜金属及其重要化合物的主要性质
专题:元素及其化合物
分析:(1)由信息可知,红色物质为Cu2O,在酸溶液中发生氧化还原反应生成Cu、Cu2+;
(2)Al的价电子数为3,3×13=39不稳定,需要得到1个电子为40个价电子的最稳定结构;合金中Al的物质的量=
=0.05mol,n(HCl)=0.08×3mol/L=0.24mol,由2Al+6HCl═2AlCl3+3H2↑,可知0.05molAl完全反应消耗0.15mol HCl,小于0.24mol,故HCl有剩余,根据Al计算生成氢气体积;
反应后的溶液中加入氨水,使Al3+恰好完全沉淀,反应后的溶液中溶质为NH4Cl,根据氯离子守恒可知n(NH4Cl)=n(HCl),再根据N原子守恒计算n(NH3),进而计算消耗氨水的体积.
(2)Al的价电子数为3,3×13=39不稳定,需要得到1个电子为40个价电子的最稳定结构;合金中Al的物质的量=
| 1.5g×90% |
| 27g/mol |
反应后的溶液中加入氨水,使Al3+恰好完全沉淀,反应后的溶液中溶质为NH4Cl,根据氯离子守恒可知n(NH4Cl)=n(HCl),再根据N原子守恒计算n(NH3),进而计算消耗氨水的体积.
解答:
解:(1)由信息可知,红色物质为Cu2O,在酸溶液中发生氧化还原反应生成Cu、Cu2+,发生的离子反应为Cu2O+2H+═Cu+Cu2++H2O,
故答案为:Cu2O+2H+═Cu+Cu2++H2O;
(2)Al的价电子数为3,3×13=39不稳定,需要得到1个电子为40个价电子的最稳定结构,即Al13-为稳定结构,带电荷数为1;
合金中Al的物质的量=
=0.05mol,n(HCl)=0.08×3mol/L=0.24mol,
则 2Al+6HCl═2AlCl3+3H2↑,
0.05mol 0.15mol
Al完全反应消耗0.15molHCl,小于0.24mol,故HCl有剩余,由方程式可知,生成氢气物质的量=0.05mol×
=0.075mol,故生成氢气的体积=0.075mol×22.4L/mol=1.68L,
滤液稀释到100mL,取出稀释液5mL,加入0.6mol?L-1的氨水使Al3+恰好完全沉淀,反应后的溶液中溶质为NH4Cl,根据氯离子守恒可知n(NH4Cl)=n′(HCl)=0.24mol×
=0.012mol,再根据N原子守恒可知n(NH3)=0.012mol,故需要氨水的体积=
=0.02L=20mL,
故答案为:1;1.68;20.
故答案为:Cu2O+2H+═Cu+Cu2++H2O;
(2)Al的价电子数为3,3×13=39不稳定,需要得到1个电子为40个价电子的最稳定结构,即Al13-为稳定结构,带电荷数为1;
合金中Al的物质的量=
| 1.5g×90% |
| 27g/mol |
则 2Al+6HCl═2AlCl3+3H2↑,
0.05mol 0.15mol
Al完全反应消耗0.15molHCl,小于0.24mol,故HCl有剩余,由方程式可知,生成氢气物质的量=0.05mol×
| 3 |
| 2 |
滤液稀释到100mL,取出稀释液5mL,加入0.6mol?L-1的氨水使Al3+恰好完全沉淀,反应后的溶液中溶质为NH4Cl,根据氯离子守恒可知n(NH4Cl)=n′(HCl)=0.24mol×
| 5mL |
| 100mL |
| 0.012mol |
| 0.6mol/L |
故答案为:1;1.68;20.
点评:本题考查物质的性质及有关计算,为高频考点,把握习题中的信息及发生的反应、反应中物质的量的关系为解答的关键,侧重分析与计算能力的考查,题目难度中等.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
化学是一门中心学科,与社会发展的需要有密切的关系.下列说法中,不正确的是( )
| A、用食醋可除去热水壶内壁的水垢 |
| B、合成纤维和光导纤维都是新型无机非金属材料 |
| C、酒精能使蛋白质变性,可用于杀菌消毒 |
| D、白酒用于增稠增香的塑化剂邻苯二甲酸二丁酯不溶于水,有毒 |
下列叙述的乙炔的结构和性质中,既不同于乙烯,也不同于乙烷的是( )
| A、存在不饱和键 |
| B、不易发生取代反应,易发生加成反应 |
| C、分子中的所有原子都处在同一条直线上 |
| D、能使酸性KMnO4溶液褪色 |

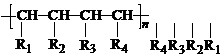 nCH=CH+nCH=CH
nCH=CH+nCH=CH