��Ŀ����
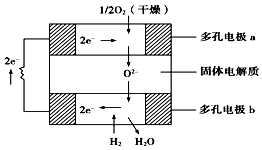
����Ŀ��ijͬѧ���һ��ȼ�ϵ��������ͼ��ʾ����Ŀ����̽���ȼҵԭ���ʹ�ͭ�ľ���ԭ����������װ����XΪ�����ӽ���Ĥ��
����Ҫ��ش�������⣺
��1��ͨ�������ĵ缫Ϊ________�������������������������������ĵ缫��ӦʽΪ__________��
��2��ʯī�缫Ϊ________����������������������������Ӧһ��ʱ�������װ���е����̪��Һ��________����������������ʯī������������Һ�ȱ�졣
��3�������ͭ�к���п���������ʣ���װ���з�Ӧһ��ʱ�䣬����ͭ��ҺŨ�Ƚ�________����������������С������������������ͭ�缫�ϵĵ缫��ӦʽΪ____________________��
���𰸡� ���� H2��2e����2OH��===2H2O ���� ���� ��С Cu2����2e��===Cu
����������1��ȼ�ϵ���ǽ���ѧ��ת��Ϊ���ܵ�װ�ã�����ԭ��أ�Ͷ��ȼ�ϵĵ缫�Ǹ�����Ͷ���������ĵ缫������������ͨ�������ĵ缫�Ǹ���������������ʧ���Ӻ����������ӷ�Ӧ����ˮ���缫��ӦʽΪ��H2��2e����2OH��=2H2O����2���ҳ���������ȼ�ϵ���£�����ӵ�Դ���ڵ��أ����缫����ԭ��صĸ�������������������ʯī�缫�������������������ӷŵ����������������������ӷŵ磬����������������������Ũ�ȴ���������Ũ����Һ�ʼ��ԣ����Է�Ӧһ��ʱ�������װ���е����̪��Һ����������Һ�ȱ������4�������ͭ�к���п���������ʣ������ϲ���ͭ����пʧ���ӽ�����Һ������������ͭ������ת�Ƶ��������֪���������ܽ��ͭС��������������ͭ�����Ա�װ���з�Ӧһ��ʱ�䣬����ͭ��ҺŨ�Ƚ���С����ͭ�缫���������缫��ӦʽΪ��Cu2����2e��=Cu��

 Ӣ��СӢ������Ĭдϵ�д�
Ӣ��СӢ������Ĭдϵ�д� �����ҵ���������ͯ������ϵ�д�
�����ҵ���������ͯ������ϵ�д�