题目内容
已知:①25℃时弱电解质电离平衡数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13;
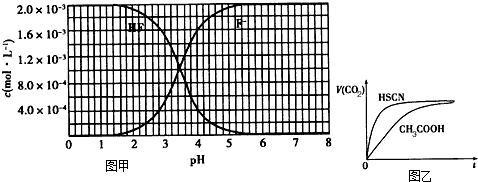
②25℃时,2.0×10-3mol/L氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如图1所示:
请根据以下信息回答下列问题:
(1)25℃时,将20mL0.10mol/LCH3COOH溶液和20mL0.10mol/LHSCN溶液分别与20mL0.10mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:①反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是______,②反应结束后所得两溶液中,c(CH3COO-)______c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka≈______.
②25℃时,2.0×10-3mol/L氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如图1所示:

请根据以下信息回答下列问题:
(1)25℃时,将20mL0.10mol/LCH3COOH溶液和20mL0.10mol/LHSCN溶液分别与20mL0.10mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:①反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是______,②反应结束后所得两溶液中,c(CH3COO-)______c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka≈______.
(1)①反应速率与氢离子浓度成正比,硫氰酸的电离平衡常数大于醋酸,则硫氰酸的电离程度大于醋酸,等浓度的两种溶液中,硫氰酸中氢离子浓度大于醋酸,所以醋酸的反应速率小于硫氰酸,
故答案为:相同的起始条件,两种酸的电离程度不同导致溶液中起始反应时氢离子浓度不同引起反应速率不同;
②酸的电离平衡常数越大,酸的电离程度越大则酸的酸性越强,其酸根水解能力越小,硫氰酸的电离平衡常数大于醋酸,所以醋酸根离子的水解能力大于硫氰酸根离子,则c(CH3COO-)<c(SCN-),故答案为:<;
(3)根据图象知,当pH=4时,c(H+)=10-4 mol/L,c(F-)=1.6×10-3 mol/L,c(HF)=4×10-4 mol/L,
电离平衡常数K=
=
=4×10-4,
故答案为:4×10-4.
故答案为:相同的起始条件,两种酸的电离程度不同导致溶液中起始反应时氢离子浓度不同引起反应速率不同;
②酸的电离平衡常数越大,酸的电离程度越大则酸的酸性越强,其酸根水解能力越小,硫氰酸的电离平衡常数大于醋酸,所以醋酸根离子的水解能力大于硫氰酸根离子,则c(CH3COO-)<c(SCN-),故答案为:<;
(3)根据图象知,当pH=4时,c(H+)=10-4 mol/L,c(F-)=1.6×10-3 mol/L,c(HF)=4×10-4 mol/L,
电离平衡常数K=
| C(H+).C(F-) |
| C(HF) |
| 10-4×1.6×10-3 |
| 4×10-4 |
故答案为:4×10-4.

练习册系列答案
相关题目