题目内容
【题目】在2L带气压计的恒容密闭容器中通入2molX(g)和1molY(g),发生反应:2X(g)+Y(g)![]() 2Z(g); ΔH <0若达到平衡时Z的物质的量浓度为0.45 molL-1。请回答下列问题。
2Z(g); ΔH <0若达到平衡时Z的物质的量浓度为0.45 molL-1。请回答下列问题。
(1)若反应经历5min达到平衡,则Y的平均反应速率为____________。
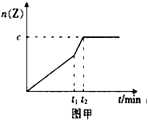
(2)相同条件下进行反应,在t 1 时刻,只改变下列某一种条件,其曲线图像如图甲。若c=0.90mol,t 1 时刻改变的条件是_________(填选项编号,A.升温 B.降温 C.加压 D.减压 E.加催化剂),t 2 _______5min (填“>”,“<”或“=”)。
(3)在粗制CuSO45H2O晶体中常含有杂质Fe2+。
①在提纯时为了除去Fe2+,常加入合适的氧化剂,使Fe2+氧化为Fe3+,下列物质可选用的是:__________
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②已知某温度下Fe (OH)3的溶度积Ksp=1.0×10-38,通常认为残留在溶液中的离子浓度小于1.0×10-5molL-1时就认为沉淀完全,则Fe3+完全沉淀时溶液的pH=______________。
(4)常温下0.1 molL-1的CH3COOH溶液加水稀释过程中,下列各项数值一定变小的是___________
A.c(H+) B.c(H+)/ c(CH3COOH)
C.c(H+)c(OH-) D.c(OH-)/ c(H+)
(5)一定温度下,在一固定容积的密闭容器中,可逆反应A(g)+2B(g)![]() 4C(g)ΔH>0,达平衡时,c(A)=2molL-1,c(B)=7molL-1,c(C)=4molL-1,试确定B的起始浓度c(B)的取值范围是____________。
4C(g)ΔH>0,达平衡时,c(A)=2molL-1,c(B)=7molL-1,c(C)=4molL-1,试确定B的起始浓度c(B)的取值范围是____________。
【答案】 0.045 molL-1min-1 E < B 11 A 3molL-1≤c(B)≤9molL-1
【解析】设消耗的Y物质的量为x
2X(g)+Y(g)![]() 2Z(g)
2Z(g)
起始量(mol) 2 1 0
变化量(mol) 2x x 2x
平衡量(mol) 2-2x 1-x 2x
若达到平衡时气体总物质的量变为原来的0.85倍,2-2x+1-x+2x=(2+1)×0.85
x=0.45mol,则:
(1)若反应经历5min达到平衡,则Y的平均反应速率=![]() =0.045mol/(Lmin);
=0.045mol/(Lmin);
(2)若c=0.90mol,图象分析可知反应速率增大,但最后大点的平衡状态不变,反应是气体体积变化的反应,所以改变的条件是加入了催化剂的作用,t1时刻改变的条件是加入了催化剂,反应速率增大,达到平衡所需要的时间缩短,小于5min;
(3)加入的物质不仅要具有氧化性还引入新的杂质,反应后可以生成硫酸根离子或水,氯水、高锰酸钾和硝酸虽然能氧化二价铁离子生成三价铁离子,能引进新的杂质离子,双氧水氧化亚铁离子同时生成水,水不是杂质,故选B;
(4)A.CH3COOH溶液加水稀释过程中,由于溶液体积增大,而醋酸的电离程度较小,则稀释后溶液中c(H+)减小,故A正确;B.稀释过程中氢离子的物质的量增大、醋酸的物质的量减小,由于在同一溶液中,溶液体积相同,则c(H+)/ c(CH3COOH)的比值增大,故B错误;C.溶液中c(H+)c(OH-)之积为水的离子积,稀释后溶液温度不变,则水的离子积不变,故C错误;D.稀释过程中氢离子浓度减小,氢氧根离子浓度增大,则c(OH-)/ c(H+)的比值增大,故D错误;故选A;
(5)可逆反应A(g)+2B(g)4C(g)△H>0达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(c)=4mol/L,若A完全转化为C,消耗B为04mol/L,则B最小值为3mol/L,若C完全转化为反应物,生成2molB,则B的最大值为9mol/L,因反应为可逆反应,均不能完全转化,则B的浓度范围为3mol/L<c(B)<9mol/L。

 阅读快车系列答案
阅读快车系列答案