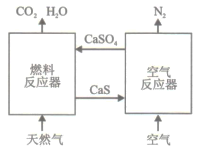
题目内容
【题目】铝锰合金可作炼钢脱氧剂。某课外小组欲测定铝锰合金中锰的含量。
I硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液的浓度滴定
步骤1:取20.00mL 0.015mol/L K2Cr2O7标准液于250mL锥形瓶中,加入20mL稀硫酸和5mL浓磷酸,用硫酸亚铁铵溶液滴定,接近终点时加2滴R溶液作指示剂,继续滴定至终点,消耗的体积为V1mL。
步骤2:重复步骤1实验,接近终点时加4滴R溶液,消耗的体积为V2mL.
Ⅱ过硫酸铵[(NH4)2S2O8]催化氧化滴定法测定锰含量
取mg铝锰合金于锥形瓶中,加入适量的浓磷酸,加热至完全溶解,稀释冷却谣匀,再加入少量的硝酸银溶液、过量的过硫酸铵溶液,加热煮沸至无大量气泡冒出,冷却至室温(此时溶液中锰的化合价为+7),用标定的硫酸亚铁铵溶液进行滴定,根据实验数据计算铝锰合金中锰的含量。
[查阅资料]①酸性条件下,Cr2O72-具有很强的氧化性,易被还原为绿色的Cr3+;
②R溶液的变色原理: ![]()
(1)Ⅰ中步骤1.2需要的玻璃仪器有锥形瓶、胶头滴管,_______、________。
(2)Ⅰ中滴定过程,主要反应的离子方程式是________。
(3)Ⅰ中步骤2的主要作用是_________
(4)Ⅱ中硫酸亚铁铵溶液的滴定浓度是_________mol/L (用含V1、V2的代数式表示)。
(5)Ⅱ中加入硝酸银溶液的目的是________。
(6)Ⅱ中若未加热煮沸无大量气泡冒出,锰含量测定结果将_______(填“偏大”“偏小”或“无影响”)。
(7)为了提高该实验的准确度和可靠度,需进行________。
【答案】 酸式滴定管 量筒或移液管 14H++C2O72- +6Fe2+=6Fe3++2Cr3++7H2O 校正指示剂 1.8/(2V1-V2) 作为催化剂,加快氧化速率 偏大 平行实验
【解析】(1)因为硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液显酸性,K2Cr2O7溶液有强氧化性,所以I中滴定实验需要用到酸式滴定管,可使用量筒向滴定管中取液体,也可以使用移液管取用,故Ⅰ中需要的玻璃仪器除了锥形瓶、胶头滴管外,还有酸式滴定管、量筒(或移液管)。
(2)Ⅰ中滴定过程,酸性条件下用硫酸亚铁铵溶液滴定K2Cr2O7标准液,Fe2+与Cr2O72-发生氧化还原反应,离子方程式为:14H++Cr2O72-+6Fe2+=6Fe3++2Cr3++7H2O。
(3)根据[查阅资料]②R溶液的变色原理可得,变色过程要消耗一定量的氧化剂或还原剂,所以对指示剂用量加以校正是提高准确度的关键,因此Ⅰ中步骤2的主要作用是:校正指示剂。
(4)加2滴R溶液作指示剂时消耗硫酸亚铁铵溶液V1mL,为校正指示剂所造成的误差,加4滴R溶液时消耗硫酸亚铁铵溶液V2mL,所以K2Cr2O7标准液实际消耗的硫酸亚铁铵溶液为:(2V1-V2)mL,根据反应离子方程式可得关系:Cr2O72-~6Fe2+,又根据已知20.00mL 0.015mol/L K2Cr2O7标准液,所以硫酸亚铁铵溶液的浓度为: ![]() mol/L=
mol/L=![]() mol/L。
mol/L。
(5)由已知,催化氧化滴定法测定铝锰合金中锰含量,过硫酸铵[(NH4)2S2O8]作氧化剂与锰在催化剂作用下发生氧化还原反应,所以Ⅱ中加入硝酸银溶液的目的是:作为催化剂,加快氧化速率。
(6)Ⅱ中过硫酸铵是过量的,存在反应(NH4)2S2O8+2H2O=2NH4HSO4+H2O2,加热煮沸至无大量气泡冒出,是为了除去溶液中的氧化性物质,若未加热煮沸无大量气泡冒出,则消耗还原剂硫酸亚铁铵的物质的量偏大,锰含量测定结果将偏大。
(7)为了提高该实验的准确度和可靠度,需防止偶然误差的产生,可取两个以上相同的样品,以完全一致的条件进行实验,看其结果的一致性,即进行平行实验。

 阅读快车系列答案
阅读快车系列答案【题目】下表为元素周期表短同期的一部分, A、B、C、D、E五种元素在周期表中的位置如下图所示。C元素的原子最外层电子数为次外层的3倍。
A | E | C | |
B | D |
回答下列问题:
(1)B元素在周期表中的位置为__________。
(2)D的最高价氧化物对应水化物的化学式为__________。
(3)下列事实能说明C元素的非金属性比硫元素的非金属性强的是__________。
a.C单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molC单质比1molS得电子多
c.C和S两元素的简单氢化物受热分解,前者的分解温度高
d. C元素的简单氢化物沸点高于S元素的简单氢化物
(4)B与D两元素的单质反应生成化合物M,它的结构类似甲烷,写出M的电子式_____。
(5)A与镁形成的1mol化合物N与水反应,生成2molMg(OH)2和1mol气态烃,该烃分子中碳氢质量比为9:1,写出N与水反应的化学方程式______________________________。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L2.2mol/LNaOH溶液和1molO2,则两种气体的分子式及物质的量分别为__________。