题目内容
(共10分)回答下列有关周期表的问题:
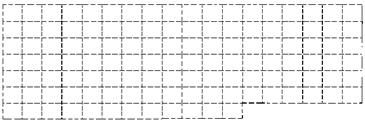
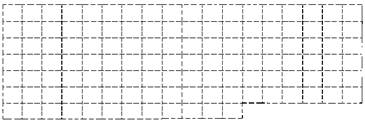
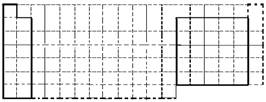
(1)在下图所示元素周期表中请用实线(黑色中性笔)画出主族元素的边界。
(2)元素甲是第三周期ⅦA族元素,甲元素与另两种非金属元素可组成离子化合物A。写出A的电子式________。
(3)在所有的气态氢化物中,元素乙的氢化物最稳定,写出元素乙的单质与水反应的化学方程式_____________________________________________________________
(4)金属元素丙形成的某化合物的溶液常用于检验CO2,则元素丙的简单离子与元素甲的简单离子的半径大小关系是________________(用离子符号表示)
(5)丁与戊分别是第三周期中简单离子半径最小和最大的金属元素,写出丁元素的单质与戊最高价氧化物对应的水化物溶液反应的离子方程式_____________________。
(方程式2分,共10分)
(1) 
(2)  (3)2F2+2H2O===4HF+O2
(3)2F2+2H2O===4HF+O2
(4)r(Ca2+)<r(Cl-) (5) 2Al+2OH-+2H2O=2AlO2-+3H2↑
【解析】(1)考查元素周期表的结构。
(2)元素甲是第三周期ⅦA族元素,则甲氯元素。甲元素与另两种非金属元素可组成离子化合物A,所以A是氯化铵,电子式是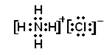 。
。
(3)非金属性越强,相应氢化物的稳定性越强。F是最强的非金属,即乙是F,所以反应的方程式是2F2+2H2O===4HF+O2。
(4)金属元素丙形成的某化合物的溶液常用于检验CO2,所以丙是钙。由于核外电子排布相同的微粒,起微粒半径随原子序数的增大而减小,因此离子半径是r(Ca2+)<r(Cl-)。
(5)丁与戊分别是第三周期中简单离子半径最小和最大的金属元素,则丁是铝,戊是钠,所以反应的方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案