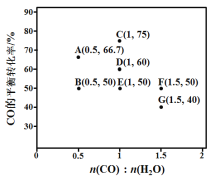
题目内容
【题目】工业上以石油裂解气E为原料,通过下列化学反应制取1,3-丙二醇。
![]()
已知E能使酸性高锰酸钾溶液退色;同温同压下,E的密度是H2的21倍;E分子中有3种不同化学环境的氢原子,其个数比为1∶2∶3。下列关于E的叙述不正确的
A. E的相对分子质量为42
B. E的结构简式为CH2=CHCH3
C. E分子中所有的碳原子在同一平面上
D. 反应①是将E通入溴的四氯化碳溶液中
【答案】D
【解析】
E是石油裂解气,属于烃,E能使高锰酸钾溶液褪色,含有不饱和键。同温同压下,E的密度是H2的21倍,则E的相对分子质量为21×2=42,用“商余法”42÷12 =3…6,则E的分子式为C3H6,E分子中有3种不同化学环境的氢原子,其个数比为1∶2∶3,所以E的结构简式为CH2=CHCH3,由转化关系可知,E与溴在光照条件下发生取代反应生成CH2=CHCH2Br,
A.密度之比等于相对分子质量之比,E的密度是H2的21倍,则E的相对分子质量为21×2=42,故A正确;
B.由上述分析可知,E的结构简式为CH2=CHCH3,故B正确;
C.E为CH2=CHCH3,甲基连接在碳碳双键上,所有的碳原子在同一平面内,故C正确;
D.E为CH2=CHCH3,经过反应①得到CH2=CHCH2Br,应是E与溴发生取代反应,不是与溴发生加成反应,故D错误。
故选D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目