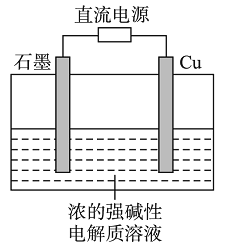
题目内容
【题目】25℃时,向1L 0.1moL某一元酸HR溶液中逐渐加入BOH,若溶液温度和体积保持不变,所得混合溶液的与pH变化的关![]() 、
、![]() 系如图中M或N线所示。下列叙述正确的是
系如图中M或N线所示。下列叙述正确的是

A. M线表示![]() 随pH的变化 B. 若温度升高,两条线均往上平移
随pH的变化 B. 若温度升高,两条线均往上平移
C. BR溶液呈碱性 D. 25℃,0.1 mol/L NaR溶液的pH约为10
【答案】B
【解析】
A.随着碱的加入,发生反应:HR+BOH=BR+H2O,溶液中c(R-)增大,c(HR)减小,lg![]() 增大,即pH增大,lg
增大,即pH增大,lg![]() 增大,所以N表示,lg
增大,所以N表示,lg![]() 随pH的变化,A错误;
随pH的变化,A错误;
B.若升高温度,HR、BOH电离程度增大,离子浓度增大,电解质分子浓度降低,所以离子遇分子浓度的比值增大,其对数就增大,因此两条线均往上平移,B正确;
C.M表示BOH,N表示的是HR,根据图像可知,当lg![]() =0,即
=0,即![]() =1时,pH=8,c(OH-)=10-6mol ,K(BOH)=
=1时,pH=8,c(OH-)=10-6mol ,K(BOH)=![]() 10-6mol/L,lg
10-6mol/L,lg![]() =0时,
=0时,![]() =1,此时溶液的pH=5,c(H+)=10-5mol,K(HR)=
=1,此时溶液的pH=5,c(H+)=10-5mol,K(HR)=![]() =10-5mol>10-6mol/L=K(BOH),弱酸的电离平衡常数比弱碱的电离平衡常数大,所以BR溶液呈酸性,C错误;
=10-5mol>10-6mol/L=K(BOH),弱酸的电离平衡常数比弱碱的电离平衡常数大,所以BR溶液呈酸性,C错误;
D.根据lg![]() =0时,pH=5,可知K(HR)=10-5,所以NaR的水解平衡常数Kh=
=0时,pH=5,可知K(HR)=10-5,所以NaR的水解平衡常数Kh=![]() ,则0.1mol/LNaR溶液的pH大约为9,D错误;
,则0.1mol/LNaR溶液的pH大约为9,D错误;
故合理选项是B。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案【题目】物质A可发生如图所表示的反应:
写出相应物质的化学式和类别(填在表格内),并依次写出各步反应的化学方程式。
A | B | C | D | E | |
化学式 | Cu | CuCl2 | ____ | ____ | ____ |
类 别 | _____ | _____ | 碱 | 氧化物 | 盐 |
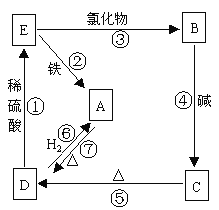
(1)______________________________。
(2)______________________________。
(3)______________________________。
(4)______________________________。
(5)______________________________。
(6)______________________________ 。
(7)______________________________