题目内容
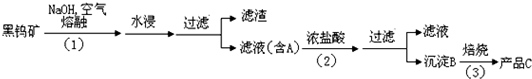
钨是我国的丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,有“光明使者”的美誉。钨在自然界主要以钨(Ⅴ)酸盐的形式存在。有开采价值的钨矿石是白钨矿和黑钨矿。白钨矿的主要成分是钨酸钙(CaWO4),黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写作(Fe,Mn)WO4。黑钨矿传统冶炼工艺的第一阶段是碱熔法:
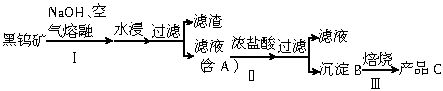
其中A、B、C都是钨的化合物。
(1)写出上述流程中A、B、C的化学式:A_____________、B_____________、C____________,以及步骤Ⅰ、Ⅱ、Ⅲ中发生反应的化学方程式:_________________、_______________、________________。
(2)钨冶炼工艺的第二阶段则是用碳、氢气等还原剂把氧化钨还原为金属钨。对钨的纯度要求不高时,可用碳作还原剂。写出用碳还原氧化钨制取金属钨的化学方程式:____________________________________。
(3)为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂,为什么?______________________,写出用氢气还原氧化钨制取金属钨的化学方程式:_____________________。
(1)Na2WO4;H2WO4;WO3;
4FeWO4(s)+8NaOH(l)+O2(g)=4Na2WO4(l)+2Fe2O3(s)+4H2O(g)、2MnWO4(s)+4NaOH(l)+O2(g)=2Na2WO4(l)+2MnO2(s)+2H2O(g);
Na2WO4(aq)+2HCl(aq)=H2WO4(s)+2NaCl(aq);
H2WO4(s) WO3(s)+H2O(g)
WO3(s)+H2O(g)
(2)2WO3(s)+3C(石墨) 2W(s)+3CO2(g)
2W(s)+3CO2(g)
(3)如果用碳做还原剂,混杂在金属中的碳不易除去,而且碳会在高温下和金属钨反应生成碳化钨(WC),不容易获得纯的金属钨;WO3(s)+3H2(g) W(s)+3H2O(g)
W(s)+3H2O(g)
【试题分析】
(1)从题中信息可知钨酸钠应是可溶于水的盐,黑钨矿中铁、锰元素都进入了滤渣中,所以滤液A的主要成分是Na2WO4,B是不溶于水的H2WO4,最后钨元素将转变为WO3。有关反应的化学方程式见下面答案(1)。
(2)根据以前所学过的知识不难写出用碳还原氧化钨制取金属钨的化学方程式:2WO3(s)+3C(石墨)
 2W(s)+3CO2(g)。
2W(s)+3CO2(g)。(3)因为钨的熔点很高,不易转变为液态。如果用碳做还原剂,混杂在金属中的碳不易除去,而且碳会在高温下和金属钨反应生成碳化钨(WC),不容易获得纯的金属钨,用氢气作还原剂就不存在这些问题。反应的化学方程式为WO3(s)+3H2(g)
 W(s)+3H2O(g)。
W(s)+3H2O(g)。 
练习册系列答案
相关题目