题目内容
【题目】硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害。
Ⅰ.已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)=BaS(s)+4CO(g) ΔH=+571.2kJ·mol-1
BaS(s)=Ba(s)+S(s) ΔH=+460kJ·mol-1
已知:2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1
则:Ba(s)+S(s)+2O2(g)=BaSO4(s)ΔH=__。
Ⅱ.SO2的尾气处理通常有以下几种方法:
(1)活性炭还原法
反应原理:恒温恒容时2C(s)+2SO2(g)=S2(g)+2CO2(g)。
反应进行到不同时间测得各物质的浓度如图:
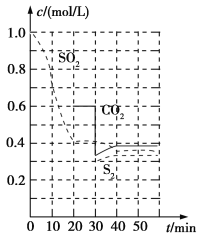
①0~20min反应速率表示为v(SO2)=__;
②30min时,改变某一条件平衡发生移动,则改变的条件最有可能是__;
③40min时,平衡常数K=__。
(2)亚硫酸钠吸收法
①Na2SO3溶液吸收SO2的离子方程式为__;
②常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定正确的是__(填序号)。
a.c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
b.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
c.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)
d.溶液中c(H+)=1×10-8mol/L
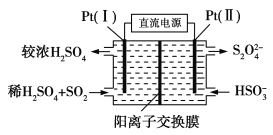
(3)电化学处理法
①如图所示,Pt(Ⅰ)电极的反应式为__;
②当电路中转移0.02mole-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加__mol离子。
【答案】1473.2kJmol1 0.03mol/( Lmin) 减少CO2的浓度 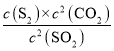 SO32+SO2+H2O=2HSO3 abc SO22e+2H2O=SO42+4H+ 0.03
SO32+SO2+H2O=2HSO3 abc SO22e+2H2O=SO42+4H+ 0.03
【解析】
Ⅰ.已知①BaSO4(s)+4C(s)=BaS(s)+4CO(g) ΔH=+571.2kJ·mol-1
②BaS(s)=Ba(s)+S(s) ΔH=+460kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1,
根据盖斯定律:③×2①②得方程式Ba(s)+S(s)+2O2(g)=BaSO4(s)据此计算;
Ⅱ.(1)①根据v=![]() 计算v(SO2);
计算v(SO2);
②30min时瞬间,二氧化碳浓度降低,S2的浓度不变,而后二氧化碳、S2的浓度均增大,应是减少CO2的浓度;
③平衡常数K=![]() ,注意固体和纯液体不写入表达式;
,注意固体和纯液体不写入表达式;
(2)①Na2SO3溶液与SO2反应生成亚硫酸氢钠;
②a.根据电荷守恒判断;
b.根据物料守恒判断;
c.NaHSO3溶液中HSO3的电离程度大于其水解程度;
d.水电离出氢离子浓度等于溶液中氢氧根离子浓度,由于NaHSO3溶液的pH未知,不能计算水电离出氢离子浓度;
(3)①由图可知,Pt(Ⅰ)电极上二氧化硫被氧化生成硫酸;
②左侧电极反应式为:SO22e+2H2O=SO42+4H+,根据电子转移守恒计算生成硫酸根、氢离子的物质的量,为保持溶液电中性,多余的氢离子通过阳离子交换膜移至右侧,左侧溶液中增加离子为生成硫酸电离的离子总量。
Ⅰ.已知①BaSO4(s)+4C(s)=BaS(s)+4CO(g) ΔH=+571.2kJ·mol-1
②BaS(s)=Ba(s)+S(s) ΔH=+460kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1,
根据盖斯定律:③×2①②得方程式Ba(s)+S(s)+2O2(g)=BaSO4(s) ΔH=(221)×2(+460)(+571.2)=1473.2kJmol1;故答案为:1473.2kJmol1;
Ⅱ.(1)①由图可知,020min内二氧化硫浓度变化量为1mol/L0.4mol/L=0.6mol/L,故v(SO2)=![]() =0.03mol/( Lmin);故答案为:0.03mol/( Lmin);
=0.03mol/( Lmin);故答案为:0.03mol/( Lmin);
②30min时瞬间,二氧化碳浓度降低,S2的浓度不变,而后二氧化碳、S2的浓度均增大,应是减少CO2的浓度;故答案为:减少CO2的浓度;
③恒温恒容时2C(s)+2SO2(g)S2(g)+2CO2(g),平衡常数K=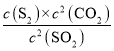 ;故答案为:
;故答案为: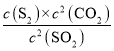 ;
;
(2)①Na2SO3溶液与SO2反应生成亚硫酸氢钠,反应离子方程式为:SO32+SO2+H2O=2HSO3,故答案为:SO32+SO2+H2O=2HSO3;
②a.根据电荷守恒:c(Na+)+c(H+)=2c(SO32)+c(HSO3)+c(OH),故溶液中c(Na+)+c(H+)>c(SO32)+c(HSO3)+c(OH),故a正确;
b.溶液中S元素以SO32、HSO3、H2SO3形式存在,Na元素与硫元素物质的量之比为1:1,故溶液中c(Na+)=c(SO32)+c(HSO3)+c(H2SO4),故b正确;
c.NaHSO3溶液中HSO3的电离程度大于其水解程度,故溶液中c(Na+)>c(HSO3)>c(H+)>c(SO32),故c正确;
d.水电离出氢离子浓度等于溶液中氢氧根离子浓度,由于NaHSO3溶液的pH未知,不能计算水电离出氢离子浓度,故d错误;
故答案为:abc;
(3)①由图可知,Pt(Ⅰ)电极上二氧化硫被氧化生成硫酸,电极反应式为:SO22e+2H2O=SO42+4H+;故答案为:SO22e+2H2O=SO42+4H+;
②左侧电极反应式为:SO22e+2H2O=SO42+4H+,根据电子转移守恒,生成硫酸根物质的量![]() =0.01mol,生成氢离子为0.04mol,为保持溶液电中性,0.01mol硫酸根需要0.02mol氢离子,多余的氢离子通过阳离子交换膜移至右侧,即有0.02mol氢离子移至右侧,故左侧溶液中增加离子为0.01mol+0.02mol=0.03mol;故答案为:0.03。
=0.01mol,生成氢离子为0.04mol,为保持溶液电中性,0.01mol硫酸根需要0.02mol氢离子,多余的氢离子通过阳离子交换膜移至右侧,即有0.02mol氢离子移至右侧,故左侧溶液中增加离子为0.01mol+0.02mol=0.03mol;故答案为:0.03。