题目内容
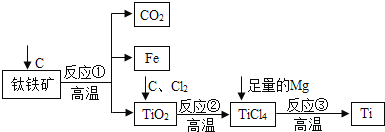
【题目】无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备,流程如下:
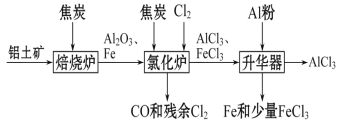
已知:AlCl3、FeCl3分别在183 ℃、315 ℃时升华
(1)铝原子的结构示意图为________,实验室配制氯化铝溶液时加入盐酸的目的是________________________。
(2)氯化炉中Al2O3、Cl2和焦炭在高温下发生反应的化学方程式为______________________炉气中残余有少量Cl2,请画出吸收Cl2的尾气装置图_____。

(3)700 ℃时,升华器中物质经充分反应后需降温实现FeCl3和AlCl3的分离。请选择合适的温度范围________________。
a.低于183 ℃ b.介于183 ℃和315 ℃之间 c.高于315 ℃
(4)样品(含少量FeCl3)中AlCl3含量可通过下列操作测得(部分物质略去)。
m克样品![]() NaAlO2溶液
NaAlO2溶液![]() Al(OH)3
Al(OH)3![]() n克Al2O3
n克Al2O3
NaAlO2溶液与过量二氧化碳反应的离子方程式为:______________________。计算该样品中Al的质量分数________(结果用m、n表示,不必化简)。
【答案】 防止Al3+水解Al2O3+3Cl2+3C
防止Al3+水解Al2O3+3Cl2+3C![]() 3CO+2AlCl3
3CO+2AlCl3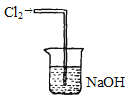 bAlO2-+CO2+2H2O=Al(OH)3↓+HCO3-27n/51m
bAlO2-+CO2+2H2O=Al(OH)3↓+HCO3-27n/51m
【解析】
铝土和焦炭矿焙烧炉中加热, Fe2O3被还原得到Fe,所以反应后得到Al2O3和Fe,加入Cl2、焦炭在氯化炉中反应,Fe、Al2O3、Cl2和C反应会生成AlCl3、FeCl3、CO,排出废气CO和Cl2,加入Al粉除去FeCl3、Fe,最后得到 AlCl3,冷凝得到AlCl3固体;据以上分析解答。
铝土和焦炭矿焙烧炉中加热, Fe2O3被还原得到Fe,所以反应后得到 Al2O3和Fe,加入Cl2、焦炭在氯化炉中反应,Fe、Al2O3、Cl2和C反应会生成AlCl3、FeCl3、CO,排出废气CO和Cl2,加入Al粉除去FeCl3、Fe,最后得到 AlCl3,冷凝得到AlCl3固体;
(1)铝原子核电荷数为13,,原子结构示意图为 ;氯化铝溶液水解显酸性,配制氯化铝溶液时加入盐酸来抑制铝离子的水解;综上所述,本题答案是:
;氯化铝溶液水解显酸性,配制氯化铝溶液时加入盐酸来抑制铝离子的水解;综上所述,本题答案是: ;防止Al3+水解。
;防止Al3+水解。
(2)根据以上分析可知,氯化炉中Al2O3、Cl2和焦炭在高温下发生反应,生成AlCl3、CO,化学方程式为:Al2O3+3Cl2+3C![]() 3CO+2AlCl3;Cl2有毒,污染空气,可用氢氧化钠溶液来吸收;吸收Cl2的尾气装置图为:
3CO+2AlCl3;Cl2有毒,污染空气,可用氢氧化钠溶液来吸收;吸收Cl2的尾气装置图为: ;综上所述,本题答案是:Al2O3+3Cl2+3C
;综上所述,本题答案是:Al2O3+3Cl2+3C![]() 3CO+2AlCl3;
3CO+2AlCl3; 。
。
(3)已知:AlCl3、FeCl3分别在183 ℃、315 ℃时升华;所以降温实现FeCl3和AlCl3的分离,合适的温度范围为介于183 ℃和315 ℃之间;综上所述,本题答案是:b。
(4)NaAlO2溶液与过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。根据流程可知,ngAl2O3的物质的量为n/102mol,根据铝元素守恒:2n(AlCl3)=n(Al2O3),n(Al)=n(AlCl3)=2×n/102mol=n/51mol,铝元素质量为n/51×27g=27n/51 g;所以样品中Al的质量分数(27n/51)/m×100%=27n/51m;综上所述,本题答案是: AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;27n/51m。