题目内容
碳酸铜和碱式碳酸铜均可溶于盐酸,转化为氯化铜。在高温下这两种化合物均能分解成氧化铜。溶解28.4g上述混合物,恰好消耗1mol/L盐酸500mL。灼烧等质量的上述混合物,得到氧化铜的质量是( )
A.35g B.30 g C.20 g D.15 g
C
【解析】
试题分析:有关的化学反应方程式为: CuCO3+2HCl=CuCl2+ CO2↑+H2O. Cu2 (OH)2CO3+4HCl=2CuCl2+ CO2↑+2H2O. CuCO3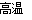 CuO+ CO2↑;Cu2 (OH)2CO3
CuO+ CO2↑;Cu2 (OH)2CO3 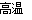 2CuO+ CO2↑+H2O.溶解固体时最后得到的是CuCl2。n(Cu)=1/2n(HCl)=1/2×1mol/L×0.5L=0.25mol. 若是灼烧等质量的上述混合物,得到氧化铜的物质的量与上述的相同。n(CuO)=n(Cu)= 0.25mol.所以m(CuO)= n(CuO)·M=0.25mol×80g/mol=20g.所以正确选项为:C。
2CuO+ CO2↑+H2O.溶解固体时最后得到的是CuCl2。n(Cu)=1/2n(HCl)=1/2×1mol/L×0.5L=0.25mol. 若是灼烧等质量的上述混合物,得到氧化铜的物质的量与上述的相同。n(CuO)=n(Cu)= 0.25mol.所以m(CuO)= n(CuO)·M=0.25mol×80g/mol=20g.所以正确选项为:C。
考点:考查守恒法在化学计算中的应用。

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案
相关题目