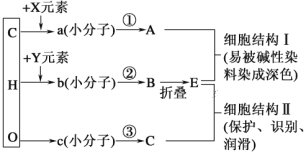
题目内容
【题目】按要求回答下列问题:
(1)苯、四氯化碳、乙醇、汽油是常见的有机溶剂,能与水互溶的是________;不溶于水,且密度比水小的是________。
(2)一瓶无色气体,可能含有CH4和CH2=CH2或其中的一种,与一瓶Cl2混合后光照,观察到黄绿色逐渐退去,瓶壁有少量无色油状小液滴。
①由上述实验现象推断出该瓶气体中一定含有CH4,你认为是否正确?________(填“正确”或“不正确”),理由是______________________。
②上述实验可能涉及的反应类型有_________________________。
(3)含有![]() 的化合物与CH2=CH2一样,在一定条件下可聚合成高分子化合物。
的化合物与CH2=CH2一样,在一定条件下可聚合成高分子化合物。
①广泛用作农用薄膜的聚氯乙烯塑料,是由![]() 聚合而成的,其化学方程式是________________________。
聚合而成的,其化学方程式是________________________。
②电器包装中大量使用的泡沫塑料的主要成分是聚苯乙烯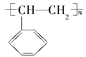 ,它是由________(写结构简式)聚合而成的。
,它是由________(写结构简式)聚合而成的。
【答案】乙醇 苯、汽油 不正确 因为CH2=CH2也可以与Cl2发生加成反应,而使黄绿色逐渐退去,生成的CH2ClCH2Cl也是油状液体 取代反应、加成反应 ![]()
![]()
【解析】
(1)大多数有机物不溶于水,而乙醇与水混溶,苯、汽油的密度比水小;
(2)①乙烯和氯气发生反应,甲烷和氯气发生反应;
②乙烯和氯气发生加成反应,甲烷和氯气发生取代反应;
(3)①聚氯乙烯塑料不具有可塑性,为线型分子,由氯乙烯发生加聚反应制取;
②聚苯乙烯由苯乙烯![]() 发生加聚反应产生。
发生加聚反应产生。
(1)苯、四氯化碳、乙醇、汽油是常见的有机溶剂,能与水互溶的是含羟基的物质-乙醇;而不溶于水,且密度比水小的纯净物为苯,汽油为混合物。即不溶于水、密度比水小的物质有汽油、苯;
(2)①乙烯可以和氯气发生加成反应,而使黄绿色逐渐褪色,生成的CH2ClCH2Cl是油状液体;而甲烷也可以和氯气发生取代反应,生成的CH2Cl2、CHCl3、CCl4都是无色油状液体,都能使黄绿色逐渐褪去;因此不能由上述实验现象推断出该瓶气体中一定含有CH4;
②乙烯和氯气发生加成反应,甲烷和氯气发生取代反应;
(3)①聚氯乙烯塑料为线型分子,可由氯乙烯发生加聚反应制取,该反应为![]() ;
;
②苯乙烯![]() 发生加聚反应产生聚苯乙烯。
发生加聚反应产生聚苯乙烯。

【题目】铜阳极泥是有色金属冶炼过程中重要的“二次资源”。其合理处理对于实现资源的综合利用具有重要意义。一种从铜阳极泥中分离提取多种金属元素的工艺流程如下:
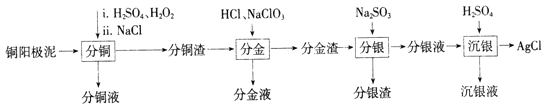
已知:分金液的主要成分为[AuCl4]-;分金渣的主要成分为AgCl和PbSO4;分银液中主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3-![]() Ag++2SO32-。
Ag++2SO32-。
(1)①“分铜”时,单质铜发生反应的化学方程式为________;反应过程中需控制适当温度,温度不宜过高或过低的原因为_______。
②已知“分铜”时 各元素的浸出率如下表所示。
Cu | Au | Ag | |
浸出率/% | 85.7 | 0 | 4.5 |
“分铜”时加入足量的NaCl的主要作用为__________
(2)“分金”时,单质金发生反应的离子方程式为___________。
(3)“沉银”时,需加入硫酸调节溶液的pH=4。已知: ![]() ,其中X表示SO32-、HSO3-或H2SO3,δ(x)与PH的关系如图所示。
,其中X表示SO32-、HSO3-或H2SO3,δ(x)与PH的关系如图所示。
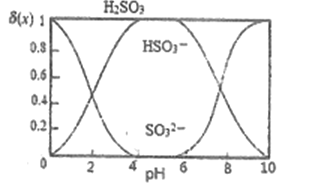
①分析能够析出AgCl的原因为_________
②调节溶液的PH不能过低,理由为__________
(4)“沉银液”加碱调至pH=8.0,Na2SO3可再生并循环利用,其再生原理为____(用离子方程式表示)。
(5)已知离子浓度≤10-5mol/L时,认为该离子沉淀完全;Ksp[Pb(OH)2]=2.5×10-16.
Ksp[Sb(OH)3])=10-41. 浸取“分银渣”可得到含0.025mol/L Pb2+的溶液( 含少量Sb3+杂质)。欲获得较纯净的Pb2+溶液,调节PH的范围为________。 (忽略溶液体积变化)