题目内容
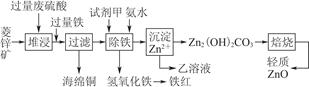
根据以下叙述制备氯化铜:先将浓盐酸用蒸汽加热至80 ℃左右,慢慢加入含有FeO杂质的CuO粉,充分反应,使其溶解。已知:FeS不溶于水,但溶于酸。
在除去溶液中的Fe2+时,可采用的方法是( )
A.可直接加碱,调整溶液的pH≥9.6
B.加入纯铜粉,将Fe2+还原为Fe
C.先将Fe2+氧化成Fe3+,再调整溶液pH至3~4
D.通入H2S使Fe2+直接沉淀
| 溶液中被沉淀离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物沉淀时,溶液的pH | ≥3.7 | ≥9.6 | ≥6.4 |
在除去溶液中的Fe2+时,可采用的方法是( )
A.可直接加碱,调整溶液的pH≥9.6
B.加入纯铜粉,将Fe2+还原为Fe
C.先将Fe2+氧化成Fe3+,再调整溶液pH至3~4
D.通入H2S使Fe2+直接沉淀
C
当溶液达到Fe2+沉淀所需pH时,溶液中的Cu2+已经沉淀完全,无法分离;Cu与Fe2+不反应;由已知信息中FeS溶于酸知选项D错;故应先把Fe2+氧化成Fe3+,再调节pH使之沉淀,最后分离即可。

练习册系列答案
相关题目
 (x+y)Cu+xCO2+(x+2y+z)H2O
(x+y)Cu+xCO2+(x+2y+z)H2O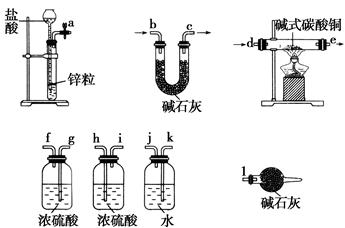
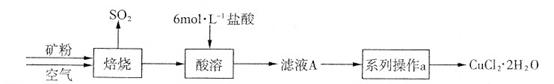
 CuCl42-(黄色)+4H2O。
CuCl42-(黄色)+4H2O。