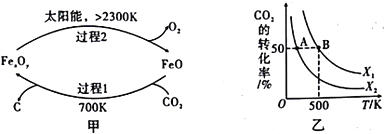
��Ŀ����
����Ŀ����ҵ�ϳ������ĺ���������XΪ��Ҫԭ�������ɽ�������PCL{![]() }����ȼ������˫��A���ϳ���·���£�
}����ȼ������˫��A���ϳ���·���£�
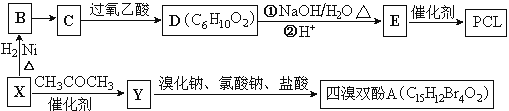
��֪���� X�������ܶ�����ͬ������H2��47������FeCl3��Һ����ɫ��CΪ![]()
��
��![]()
��1��X�ķ���ʽΪ_______________��B��������_________________��
��2��B��C����Ҫ�ķ�Ӧ�Լ���������_______________��C��D�ķ�Ӧ������________��
��3��д��X��Y�Ļ�ѧ����ʽ��_________________________________________��
��4��0.5mol����˫��A��һ����������������NaOH��Һ��Ӧ���������_____molNaOH��
��5����������������D��ͬ���칹����_______�֣������ǿռ��칹����
�ٺ��������������ֹ����� ����ʹ���CCl4��Һ��ɫ ���ܷ���������Ӧ
��6����֪��ϩ��ֱ���Ʊ������������·���Ϊ�� ![]() ��������ϩΪ�л�ԭ�ϣ�����ͷ�Ӧ������ѡ���ϳɾۺ���Ϳ��
��������ϩΪ�л�ԭ�ϣ�����ͷ�Ӧ������ѡ���ϳɾۺ���Ϳ��![]() ����д���ϳɸ�Ϳ�ϵķ�Ӧ����ͼ��______________________________________________��
����д���ϳɸ�Ϳ�ϵķ�Ӧ����ͼ��______________________________________________��
���𰸡� C6H6O ������ O2��Cu������ ������Ӧ ![]() 5 10
5 10 ![]()
��������X�������ܶ�����ͬ������H2��47��������Է�������Ϊ94����FeCl3��Һ����ɫ��˵�����з��ǻ���XΪ![]() ��X�����������ӳɷ�Ӧ����B��BΪ
��X�����������ӳɷ�Ӧ����B��BΪ![]() ��CΪ
��CΪ![]() ����B������������Ӧ��PCLΪE�������۷�Ӧ�����E�ṹ��ʽΪHO(CH2)5COOH��D����ˮ�ⷴӦ���ữ�õ�E����D�ṹ��ʽΪ
����B������������Ӧ��PCLΪE�������۷�Ӧ�����E�ṹ��ʽΪHO(CH2)5COOH��D����ˮ�ⷴӦ���ữ�õ�E����D�ṹ��ʽΪ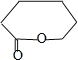 �����������Ϣ��֪��X����ȡ����Ӧ����Y��Y�ṹ��ʽΪ
�����������Ϣ��֪��X����ȡ����Ӧ����Y��Y�ṹ��ʽΪ![]() ������˫��A�ṹ��ʽΪ
������˫��A�ṹ��ʽΪ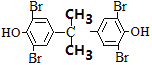 ��
��
(1)�����Ϸ�����֪XΪ���ӣ��������ΪC6H6O��BΪ���������ʴ�Ϊ��C6H6O����������
(2)B��C����Ҫ�ķ�Ӧ�Լ���������O2��Cu�����ȣ�C����D�ķ�Ӧ��������Ӧ���ʴ�Ϊ��O2��Cu�����ȣ�������Ӧ��
(3)X����ȡ����Ӧ����Y����Ӧ����ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(4)����˫��A�ܺ�NaOH��Һ����ȡ����Ӧ�����ɵķ��ǻ���HBr�ܺ�NaOH�����кͷ�Ӧ��0.5mol����˫��A��һ����������������NaOH��Һ��Ӧ���������5molNaOH���ʴ�Ϊ��5��
(5)D�ṹ��ʽΪ ��D��ͬ���칹����������������ٺ��������������ֹ����ţ�Ϊȩ�����ǻ���̼̼˫�����ǻ�������ʹ���CCl4��Һ��ɫ��˵����̼̼˫�������ܷ���������Ӧ˵������ȩ��������������ͬ���칹���У�HCOOCH2CH=C(CH3)2��HCOOC(CH3)CH=CH2��HCOOCH(CH3)CH=CHCH3��HCOOCH(CH3)C(CH3)=CH2��HCOOCH2C(CH3)=CH2CH3��HCOOC(CH2CH3)=CHCH3��HCOOC(CH3)=C(CH3)CH3��HCOOC(CH3)=CHCH2CH3��HCOOCH=C(CH3)CH3��HCOOCH=CHCH(CH3)2����10�֣��ʴ�Ϊ��10��
��D��ͬ���칹����������������ٺ��������������ֹ����ţ�Ϊȩ�����ǻ���̼̼˫�����ǻ�������ʹ���CCl4��Һ��ɫ��˵����̼̼˫�������ܷ���������Ӧ˵������ȩ��������������ͬ���칹���У�HCOOCH2CH=C(CH3)2��HCOOC(CH3)CH=CH2��HCOOCH(CH3)CH=CHCH3��HCOOCH(CH3)C(CH3)=CH2��HCOOCH2C(CH3)=CH2CH3��HCOOC(CH2CH3)=CHCH3��HCOOC(CH3)=C(CH3)CH3��HCOOC(CH3)=CHCH2CH3��HCOOCH=C(CH3)CH3��HCOOCH=CHCH(CH3)2����10�֣��ʴ�Ϊ��10��
(6)һ����������ϩ��ˮ�����ӳɷ�Ӧ����CH3CH2OH��CH3CH2OH��CH2=CH2��CO��O2��Ӧ����CH2=CHCOOCH2CH3��CH2=CHCOOCH2CH3�����Ӿ۷�Ӧ���ɸ߷��ӻ����������ͼΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��

 �ƸԺ���ȫ�����Ų��Ծ�ϵ�д�
�ƸԺ���ȫ�����Ų��Ծ�ϵ�д�