题目内容
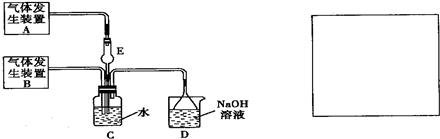
为探究Cl2、SO2同时通入H2O中发生的反应,某化学兴趣小组设计了如下图所示的实验装置。
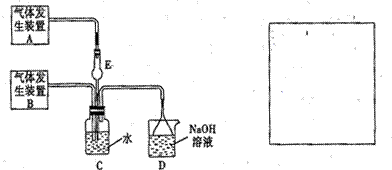
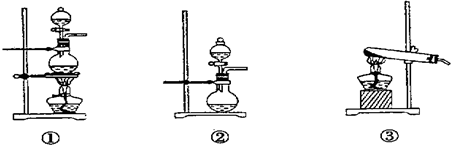
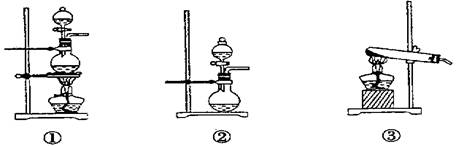
(1)化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3粉末与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸为原料制取C12。已知SO2的溶解度比Cl2大40倍,在此实验中,E仪器的作用是__________;发生装置B应选择以下三种装置中的___________(填序号)。

(2)资料显示等物质的量的Cl2、SO2同时通入H2O中恰好反应生成两种酸,请写反应的化学方程式 。
(3)为不影响产物的检验,小组成员认为上述整套装置有一处不合理,应在 装置之间(填代号)连接一装置,请在装置图右图的方框中画出简单装置图,并注明装置中盛有的试剂。
(4)已知干燥的二氧化硫和氯气在活炭催化剂存在下反应生成液SO2Cl2,反应为
SO2(g)+Cl2(g)=SO2Cl2(l)△H=—97.3kJ/mol,SO2Cl2溶于水后得到的产物与上述实验结果相同。
①为了提高上述反应中Cl2的平衡转化率,下列措施合理的是 (用编号填空)
A.缩小容器体积 B.使用催化剂 C.增加SO2浓度 D.升高温度
②已知20℃时,AgCl的溶液解度为0.00015g,Ag2SO4的溶解度为0.796g,则SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是 。
|
(2)SO2+Cl2+2H2O=2HCl+H2SO4(2分)
(3)B、C(2分)
(2分)
(4)AC(2分)AgCl(2分)

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案为探究Cl2和SO2同时通入H2O中发生的反应,某化学兴趣小组设计了下图所示的实验装置。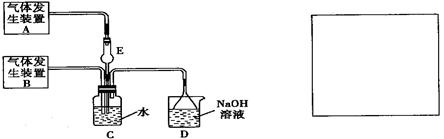
(1)化学兴趣小组的同学采用Na2SO3粉末与70%的硫酸反应制取SO2气体,采用MnO2和浓盐酸反应制取Cl2。已知SO2的溶解度比Cl2大40倍,在此实验中,E仪器的作用是
;发生装置B应选择以下三种装置中的 (填序号)[来源:Z&xx&k.Com]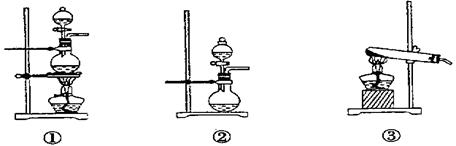
(2)资料显示等物质的量的Cl2和SO2同时通入H2O中恰好反应生成两种酸,请写出反应的离子方程式 。
(3)为了不影响产物的检验,小组成员认为上述整套装置有一处不合理,应在 装置之间(填代号)连接一装置,请在装置图右边的方框中画出简易装置图,并注明装置中盛有的试剂。
(4)已知干燥的SO2和Cl2在活性炭催化剂存在下反应生成液态的SO2Cl2,反应的方程式为:SO2(g)+Cl2(g) SO2Cl2(l) △H=" -" 97.3KJ/mol;SO2Cl2溶于水得到的产物与上述实验结果相同。
SO2Cl2(l) △H=" -" 97.3KJ/mol;SO2Cl2溶于水得到的产物与上述实验结果相同。
①为了提高上述反应中Cl2的平衡转化率,下列说法合理的是 (填序号)
| A.缩小容器体积 | B.使用催化剂 | C.增加SO2浓度 | D.升高温度 |
 10-4g,Ag2SO4的溶解度为0.796g,则SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是 。
10-4g,Ag2SO4的溶解度为0.796g,则SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是 。 
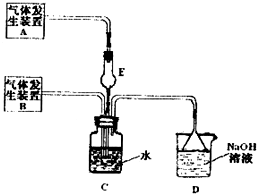 为探究Cl2、SO2同时通入H2O中发生的反应,某化学兴趣小组设计了如右图所示的实验装置.试填空.
为探究Cl2、SO2同时通入H2O中发生的反应,某化学兴趣小组设计了如右图所示的实验装置.试填空.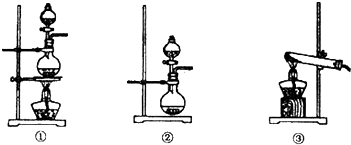

 SO2Cl2(l)
△H= - 97.3KJ/mol;SO2Cl2溶于水得到的产物与上述实验结果相同。
SO2Cl2(l)
△H= - 97.3KJ/mol;SO2Cl2溶于水得到的产物与上述实验结果相同。