题目内容
A~E是原子序数依次增大的五种短周期元素,其有关性质或结构信息如表所示:
请结合表中信息完成下列各小题:
(1)C在元素周期表中的位置是
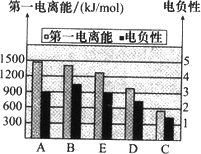
(2)如图是A~E的第一电离能和电负性数据,请回答:
①E的第一电离能大于D,其原理是(根据它们在周期表中的位置解释)
②A、B、D三种元素的非金属性由强到弱的顺序是
(3)A的常见单质分子有多个共价键.
①常温下,该单质化学性质很稳定,是因为
②该单质分子中σ键与π键的数目之比为
(4)写出C、E形成的化合物与A的氢化物在水溶液中反应的离子方程式
| 元素 | A | B | C | D | E |
| 有关性质或结构信息 | 单质是空气中主要成分之一,其氢化物水溶液呈碱性 | 原子核外有两个未成对电子 | 日常生活中常见的金属,通常用电解法冶炼其单质 | 其简单阴离子带两个单位负电荷 | 单质有毒,常温下为有色气体,常用于自来水消毒 |
(1)C在元素周期表中的位置是
第3周期ⅢA族
第3周期ⅢA族
,D的简单阴离子的核外电子排布式为1s22s22p63s23p6
1s22s22p63s23p6
.
(2)如图是A~E的第一电离能和电负性数据,请回答:
①E的第一电离能大于D,其原理是(根据它们在周期表中的位置解释)
同一周期由左到右第一电离能逐渐增大
同一周期由左到右第一电离能逐渐增大
.②A、B、D三种元素的非金属性由强到弱的顺序是
B>A>D
B>A>D
.(3)A的常见单质分子有多个共价键.
①常温下,该单质化学性质很稳定,是因为
氮氮叁键的键能很大
氮氮叁键的键能很大
.②该单质分子中σ键与π键的数目之比为
1:2
1:2
.(4)写出C、E形成的化合物与A的氢化物在水溶液中反应的离子方程式
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
.分析:A~E是原子序数依次增大的五种短周期元素,A单质是空气中主要成分之一,其氢化物水溶液呈碱性,则A为氮元素;B原子核外有两个未成对电子,则B的外围电子排布为ns2np2或ns2np4,原子序数大于氮元素小于Al元素,处于第二周期,故B为氧元素;C是日常生活中常见的金属,通常用电解法冶炼其单质,则C为Al元素;D元素简单阴离子带两个单位负电荷,处于ⅥA族,原子序数大于Al元素,故D为硫元素;E元素单质有毒,常温下为有色气体,常用于自来水消毒,故E为Cl元素,据此解答.
解答:解:A~E是原子序数依次增大的五种短周期元素,A单质是空气中主要成分之一,其氢化物水溶液呈碱性,则A为氮元素;B原子核外有两个未成对电子,则B的外围电子排布为ns2np2或ns2np4,原子序数大于氮元素小于Al元素,处于第二周期,故B为氧元素;C是日常生活中常见的金属,通常用电解法冶炼其单质,则C为Al元素;D元素简单阴离子带两个单位负电荷,处于ⅥA族,原子序数大于Al元素,故D为硫元素;E元素单质有毒,常温下为有色气体,常用于自来水消毒,故E为Cl元素,
(1)C为Al元素,原子核外有3个电子层,最外层电子数为3,处于周期表中第3周期ⅢA族;硫离子的核外电子排布式为1s22s22p63s23p6,
故答案为:第3周期ⅢA族;1s22s22p63s23p6;
(2)①由图可知,同一周期由左到右第一电离能逐渐增大,故Cl元素的第一电离能较大,
故答案为:同一周期由左到右第一电离能逐渐增大;
②电负性越大,非金属性越强,由可知,电负性B>A>D,故非金属性B>A>D,
故答案为:B>A>D;
(3)①氮气分子中存在氮氮叁键,氮氮叁键的键能很大,氮气的化学性质稳定,
故答案为:氮氮叁键的键能很大;
②N≡N三键中含有1个σ键、2个π键,故氮气分子中σ键与π键数目之比为1:2,
故答案为:1:2;
(4)氯化铝与氨水反应生成氢氧化铝与氯化铵,反应离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+.
(1)C为Al元素,原子核外有3个电子层,最外层电子数为3,处于周期表中第3周期ⅢA族;硫离子的核外电子排布式为1s22s22p63s23p6,
故答案为:第3周期ⅢA族;1s22s22p63s23p6;
(2)①由图可知,同一周期由左到右第一电离能逐渐增大,故Cl元素的第一电离能较大,
故答案为:同一周期由左到右第一电离能逐渐增大;
②电负性越大,非金属性越强,由可知,电负性B>A>D,故非金属性B>A>D,
故答案为:B>A>D;
(3)①氮气分子中存在氮氮叁键,氮氮叁键的键能很大,氮气的化学性质稳定,
故答案为:氮氮叁键的键能很大;
②N≡N三键中含有1个σ键、2个π键,故氮气分子中σ键与π键数目之比为1:2,
故答案为:1:2;
(4)氯化铝与氨水反应生成氢氧化铝与氯化铵,反应离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+.
点评:本题考查结构性质位置关系、核外电子排布规律、元素周期律、化学键、铝化合物性质等,难度中等,推断元素是解题的关键,旨在考查学生对基础知识的理解掌握.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案
相关题目
A~E是原子序数依次增大的五种短周期元素,其有关性质或结构信息如表所示:
请结合表中信息完成下列各小题:
(1)C在元素周期表中的位置是______,D的简单阴离子的核外电子排布式为______.
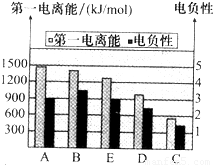
(2)如图是A~E的第一电离能和电负性数据,请回答:
①E的第一电离能大于D,其原理是(根据它们在周期表中的位置解释)______.
②A、B、D三种元素的非金属性由强到弱的顺序是______.
(3)A的常见单质分子有多个共价键.
①常温下,该单质化学性质很稳定,是因为______.
②该单质分子中σ键与π键的数目之比为______.
(4)写出C、E形成的化合物与A的氢化物在水溶液中反应的离子方程式______.
| 元素 | A | B | C | D | E |
| 有关性质或结构信息 | 单质是空气中主要成分之一,其氢化物水溶液呈碱性 | 原子核外有两个未成对电子 | 日常生活中常见的金属,通常用电解法冶炼其单质 | 其简单阴离子带两个单位负电荷 | 单质有毒,常温下为有色气体,常用于自来水消毒 |
(1)C在元素周期表中的位置是______,D的简单阴离子的核外电子排布式为______.
(2)如图是A~E的第一电离能和电负性数据,请回答:
①E的第一电离能大于D,其原理是(根据它们在周期表中的位置解释)______.
②A、B、D三种元素的非金属性由强到弱的顺序是______.
(3)A的常见单质分子有多个共价键.
①常温下,该单质化学性质很稳定,是因为______.
②该单质分子中σ键与π键的数目之比为______.
(4)写出C、E形成的化合物与A的氢化物在水溶液中反应的离子方程式______.