题目内容
【题目】H2O2分解速率速率受多种因素影响,实验测得70℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法不正确的是( )
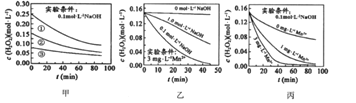
A. 图甲表明,其他条件相同时,![]() 浓度越大,其分解速率越快
浓度越大,其分解速率越快
B. 图甲![]() 和图乙因起始浓度不同不能比较
和图乙因起始浓度不同不能比较![]() 存在对化学反应速率的影响
存在对化学反应速率的影响
C. 图丙表明,![]() 作催化剂时,浓度越大催化
作催化剂时,浓度越大催化![]() 分解效果越好
分解效果越好
D. 图乙和图丙表明,相同条件下对![]() 分解速率受
分解速率受![]() 影响大
影响大
【答案】B
【解析】
A.图甲中溶液的pH相同,但浓度不同,浓度越大,相同时间内浓度的变化量越大,由此得出相同pH条件下,双氧水浓度越大,双氧水分解速率越快,选项A正确;
B.图甲中实验条件是0.1mol/L的氢氧化钠溶液中,图乙中少量Mn2+存在时,相同时间内双氧水浓度变化量:0.1mol/LNaOH溶液>1.0mol/LNaOH溶液>0mol/LNaOH溶液,由此得出:锰离子作催化剂时受溶液pH的影响,但与溶液的pH值不成正比,能比较Mn2+存在对化学反应速率的影响,选项B错误;
C.图丙表明,Mn2+作催化剂时,浓度越大催化H2O2分解效果越好,选项C正确;
D.图丙中pH相同,锰离子浓度越大,相同时间内双氧水浓度变化量越大,图乙中说明催化剂的催化效率受溶液的pH值影响,由此得出:碱性溶液中,Mn2+对H2O2分解速率的影响大,选项D正确;
答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用。工业上以CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应:
①CO(g)+2H2(g)CH3OH(g)△H1=-91kJmol-1
②2CH3OH(g)CH3OCH3(g)+H2O(g)△H2=-24kJmol-1
③CO(g)+H2O(g)CO2(g)+H2(g)△H3=-41kJmol-1
回答下列问题:
(1)写出新工艺的总反应的热化学方程式:______
(2)某温度下在2L恒容密闭容器中加入CH3OH发生反应②,测得有关数据如下:
反应时间/min | 0 | 1 | 2 | 3 | 4 |
n(CH3OH)/mol | 1.02 | 0.42 | 0.22 | 0.02 | 0.02 |
①反应在2min内以CH3OCH3表示的化学反应速率为______
②该温度下的反应的平衡常数为______
(3)一定条件下的密闭容器中,在总反应达到平衡前,要使在单位时间内提高CO的转化率,可以采取的措施是______
A 增大压强 B 加入催化剂C 减少CO2的浓度 D 降低体系温度
(4)为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果CO转化率随温度变化的规律如图1,试解释原因:______
(5)该研究者还测定了相同条件下氢气的残留量,请在图2中划出H2的残留量随温度变化的曲线______