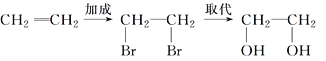题目内容
【题目】1 mol乙烯与氯气发生加成反应后,再与氯气发生完全取代反应,整个过程中消耗氯气( )
A.3 molB.6 mol
C.4 molD.5 mol
【答案】D
【解析】
乙烯分子中有1个碳碳双键,则1mol乙烯与氯气发生加成反应,消耗1mol氯气,生成CH2ClCH2Cl,CH2ClCH2Cl再与氯气发生完全取代反应,CH2ClCH2Cl中的H原子全部被Cl原子取代,生成CCl3CCl3,消耗4mol氯气,故1mol乙烯与氯气发生加成反应后,再与氯气发生完全取代反应,整个过程中消耗氯气的物质的量为1mol+4mol=5mol,D项正确;
答案选D。

【题目】X、Y、Z、M、W、Q、R是7种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | W | Q | R |
原子半径/nm | 0.186 | 0.143 | 0.104 | 0.099 | 0.070 | 0.066 | 0.032 |
主要化合价 | +1 | +3 | +6,﹣2 | +7,﹣1 | +5,﹣3 | ﹣2 | +1 |
完成下列填空:
(1)上述元素中,金属性最强的在周期表中的位置是________________________________;X、Y、Q各自形成的简单离子中,离子半径由大到小的顺序是_______(填离子符号)。
W和R按原子个数比1﹕4构成的阳离子所含的化学键是____________________。
(2)表中所列4种第三周期元素的最高价氧化物的水化物碱性最弱的是_______(填化学
式),其电离方程式为_____________________________________。
(3)M与Z相比,非金属性较强的是_____________(填元素名称),请从原子结构的角度说明理由_________________________________________________________________。
(4)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应,反应方程式如下:
![]() KMnO4+
KMnO4+![]() H2O2+
H2O2+![]() H2SO4 →
H2SO4 → ![]() K2SO4+
K2SO4+![]() MnSO4+
MnSO4+![]() O2↑+
O2↑+![]() H2O
H2O
请配平,当有0.5 mol H2O2参加此反应,电子转移的个数为______________________。