【题目】氢气、碳氧化物是合成可再生能源甲醇的基础原料,具有重要的应用前景。
(1)已知H2(g)、CO(g)和CH4(g)的燃烧热分别为285.8 kJ·mol-1、283.0 kJ·mol-1和890.0 kJ·mol-1。一定条件下,CO与H2合成甲烷的热化学方程式为:CO(g)+3H2(g)==CH4(g)+H2O(1)△H
则△H=________;该反应能自发进行的原因是_____________________________________。
(2)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)  CH3OH(g)
CH3OH(g)
反应II:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①一定温度下,在体积可变的恒压密闭容器中加入4molH2和一定量的CO发生反应I,开始时容器体积为2L,CO和CH3OH(g)的浓度随时间变化如图1。10min达到平衡,则反应I的化学平衡常数为______________(结果保留一位小数)。
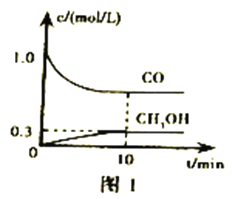
②恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,下列描述能说明反应II已经达到平衡状态的是________________(填序号)。
A.容器内CO2的体积分数不再变化 B.当CO2和H2转化率的比值不再变化
C.当水分子中断裂2NA个O-H键,同时氢分子中断裂3NA个H-H键
D.容器内混合气体的平均相对分子质量达到34.5,且保持不变
(3)用KOH作电解质的CO碱性燃料电池(如图2)作电源,用惰性电极电解含CN-废水,将CN-彻底氧化为无害气体,以净化废水。该电池的负极反应式为_____________;若开始时正、负两电极区溶液质量相等,当除去1molCN-时,理论上两电极区溶液的质量差为______g。
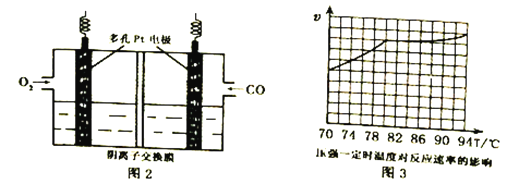
(4)工业上通过CO与甲醇制取甲酸甲酯,热化学方程式为:CO(g)+ CH3OH(g)  HCOOCH3(g)△H =-29kJ·mol-1 。科研人员对该反应进行了研究,部分研究结果如图3。实际工业生产中采用的温度是80℃,其理由是__________________________。
HCOOCH3(g)△H =-29kJ·mol-1 。科研人员对该反应进行了研究,部分研究结果如图3。实际工业生产中采用的温度是80℃,其理由是__________________________。
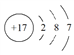
![]() ,故A错误;B、NH4Cl溶液呈酸性的原因:NH4++H2ONH3H2O+H+,导致溶液中氢离子浓度大于氢氧根离子的浓度,溶液呈酸性,故B正确;C. NH3 + HCl = NH4Cl氮的化合物转化为氮的化合物,不属于“氮的固定”,故C错误;D. 氯离子有3个电子层,半径大于N原子的半径,故D错误;故选B。
,故A错误;B、NH4Cl溶液呈酸性的原因:NH4++H2ONH3H2O+H+,导致溶液中氢离子浓度大于氢氧根离子的浓度,溶液呈酸性,故B正确;C. NH3 + HCl = NH4Cl氮的化合物转化为氮的化合物,不属于“氮的固定”,故C错误;D. 氯离子有3个电子层,半径大于N原子的半径,故D错误;故选B。
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案


