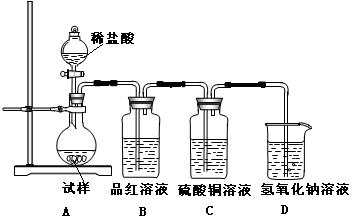
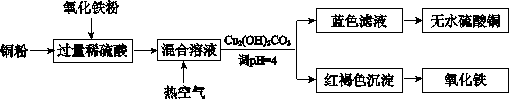
题目内容
用下图装置进行实验。
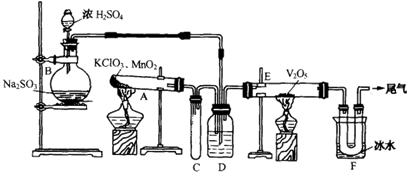
回答有关问题:
(1)玻璃管E内发生反应的化学方程式是 。
(2)小试管C的作用是 。
(3)广口瓶D内盛的试剂是 ,装置D的3个作用是① , ② , ③ 。
(4)从管E导出的气体成分是 。
(5)装置F中U形管观察到所收集物质的颜色状态是 。
(6)若U形管内收集到的物质很少,分析其原因不可能是 (填标号)。
a.装置气密性不好; b.制得的SO2中混有少量H2S杂质使催化剂中毒;c.气流速度过快。
(7)从U形管导出的尾气的处理方法是 。

回答有关问题:
(1)玻璃管E内发生反应的化学方程式是 。
(2)小试管C的作用是 。
(3)广口瓶D内盛的试剂是 ,装置D的3个作用是① , ② , ③ 。
(4)从管E导出的气体成分是 。
(5)装置F中U形管观察到所收集物质的颜色状态是 。
(6)若U形管内收集到的物质很少,分析其原因不可能是 (填标号)。
a.装置气密性不好; b.制得的SO2中混有少量H2S杂质使催化剂中毒;c.气流速度过快。
(7)从U形管导出的尾气的处理方法是 。
(1)2SO2+O2  2SO3 (2分)
2SO3 (2分)
(2)防止倒吸 (2分)
(3)浓硫酸;①干燥SO2;②使SO2和O2两种气体混合均匀;③通过观察气泡控制气体比例和气流速度(各1分)
(4)SO3、SO2、O2 (3分)
(5)无色固体(或白色固体)(2分)
(6)b (2分)
(7)用NaOH溶液吸收(或用Na2CO3溶液吸收)(2分)
 2SO3 (2分)
2SO3 (2分)(2)防止倒吸 (2分)
(3)浓硫酸;①干燥SO2;②使SO2和O2两种气体混合均匀;③通过观察气泡控制气体比例和气流速度(各1分)
(4)SO3、SO2、O2 (3分)
(5)无色固体(或白色固体)(2分)
(6)b (2分)
(7)用NaOH溶液吸收(或用Na2CO3溶液吸收)(2分)
试题分析:(1)A装置产生O2,B装置为SO2。在E装置中SO2与O2催化氧化。(2)小试管中短管,可以作为缓冲瓶,有效防倒吸。(3)依据通入E装置,D中应放入浓硫酸。作用①干燥SO2;②使SO2和O2两种气体混合均匀;③通过观察气泡控制气体比例和气流速度(4)依据化学反应限度,可以推出应有SO3、SO2、O2(5)SO3在0 0C时凝结为固态。(6)在浓硫酸的作用下不可能有H2S气体,选择b(7)SO2可以被碱液吸收。

练习册系列答案
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目