题目内容
【题目】水的电离平衡曲线如图所示,下列说法不正确的是( ) 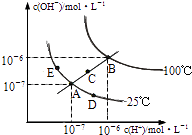
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到D点,可采用:温度不变在水中加入少量的酸
C.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体
D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
【答案】C
【解析】解:A、ADE都处于250C时,Kw相等,B点c(H+)和c(OH﹣)都大于E点的c(H+)和c(OH﹣),并且C点的c(H+)和c(OH﹣)大于A点c(H+)和c(OH﹣),c(H+)和c(OH﹣)越大,Kw越大,故B>C>A=D=E,故A正确;B、加酸,c(H+)变大,但c(OH﹣)变小,但温度不变,Kw不变,故B正确;
C、若从A点到C点,c(H+)变大,c(OH﹣)变大,Kw增大,温度应升高,故C错误;
D、若处在B点时,Kw=1×10﹣12 , pH=2的硫酸中c(H+)=10﹣2mol/L,pH=10的KOH中c(OH﹣)=10﹣2molL﹣1 , 等体积混合,恰好中和,溶液显中性,故D正确;
故选C.

【题目】海洋中蕴含着丰富的资源。利用海水提取淡水、溴和镁的部分过程如图所示。

(1)海水淡化的方法有_________________、离子交换法和电渗析法等。
(2)用纯碱吸收浓缩海水吹出的Br2: 3Br2+ 6Na2CO3+3H2O=5NaBr+ NaBrO3+6NaHCO3。若吸收3 mol Br2时,转移的电子是_________________mol。
(3)海水中部分离子的含量如下:
成分 | 含量( mg/L) | 成分 | 含量( mg/L) |
Na+ | 10560 | Cl- | 18980 |
Mg2+ | 1272 | Br- | 64 |
Ca2+ | 400 | SO42- | 2560 |
其中,Mg2+的物质的量浓度是____________mol/L。若从100 L的海水中提取镁,理论上加入沉淀剂Ca(OH)2的质量是_______________g。
(4)由Mg(OH)2得到单质Mg,以下方法最合适的是________________(填序号)。
A. Mg(OH)2 ![]() MgO
MgO![]() Mg
Mg
B. Mg(OH)2![]() MgO
MgO![]() Mg
Mg
C. Mg(OH)2![]() 无水MgCl2
无水MgCl2![]() Mg
Mg
D. Mg(OH)2 ![]() MgCl2溶液
MgCl2溶液![]() Mg
Mg
