题目内容
15.选择下列实验方法分离、提纯物质,将相应的字母填在横线上.A.萃取、分液法 B.加热分解 C.结晶法 D.分液法 E.蒸馏法 F.过滤法
(1)从硝酸钾和氯化钠的混合溶液中获得硝酸钾C.
(2)分离水和汽油的混合物D.
(3)分离饱和食盐水与泥沙的混合物F.
(4)分离相溶的CCl4(沸点76.75℃)和甲苯(沸点110.6℃)的混合物E.
(5)除去生石灰中的少量碳酸钙B.
(6)从饱和碘水中提取碘,并获得碘晶体AE.
分析 (1)硝酸钾和氯化钠的溶解度受温度影响不同;
(2)水和汽油分层;
(3)泥沙不溶于水;
(4)二者互溶,但沸点不同;
(5)碳酸钙高温分解生成CaO;
(6)碘不易溶于水,易溶于有机溶剂.
解答 解:(1)硝酸钾和氯化钠的溶解度受温度影响不同,则选择结晶法分离,故答案为:C;
(2)水和汽油分层,则选择分液法分离,故答案为:D;
(3)泥沙不溶于水,则选择过滤法分离,故答案为:F;
(4)二者互溶,但沸点不同,则选择蒸馏法分离,故答案为:E;
(5)碳酸钙高温分解生成CaO,则高温分解可除杂,故答案为:B;
(6)碘不易溶于水,易溶于有机溶剂,则加有机溶剂萃取、分液后蒸馏可得到碘,故答案为:AE.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
相关题目
5.PH3是一种无色、有剧毒的气体,其分子结构和NH3相似,下列判断正确的是( )
| A. | N-H的键长比P-H的键长短,所以PH3的沸点比NH3低 | |
| B. | PH3分子的立体构型是三角锥形,与NH3互为等电子体 | |
| C. | PH3分子是极性分子,极易溶于水,因为它与水分子间存在氢键 | |
| D. | NH3比PH3稳定,因为NH3分子间存在氢键 |
6. 物质A~E在水中电离产生下列离子:
物质A~E在水中电离产生下列离子:
常温下将各物质的溶液从1ml稀释到1000ml,PH的变化关系如图所示,期中A和D反应生成E.请回答下列问题
(1)根据PH的变化关系,写出下列物质的化学式:BNaOH DCH3COOH
(2)写出A与C反应的离子方程式NH3+H+=NH4+
(3)25℃时0.1mol/L的NH4Cl溶液的PH=a,则NH4Cl溶液中c(H+)-c(NH3•H2O)=c(OH-)(用含a的关系式表示)
(4)H2SO4的酸式盐NH4HSO4,在NH4HSO4溶液中加入NaOH使溶液呈中性,则溶液中各离子浓度大小顺序为C(Na+)>C(SO42-)>C(NH4+)>C(H+)=C(OH-).
 物质A~E在水中电离产生下列离子:
物质A~E在水中电离产生下列离子:| 阳离子 | NH4+ H+ Na+ |
| 阴离子 | OH-CH3COO- SO42- |
(1)根据PH的变化关系,写出下列物质的化学式:BNaOH DCH3COOH
(2)写出A与C反应的离子方程式NH3+H+=NH4+
(3)25℃时0.1mol/L的NH4Cl溶液的PH=a,则NH4Cl溶液中c(H+)-c(NH3•H2O)=c(OH-)(用含a的关系式表示)
(4)H2SO4的酸式盐NH4HSO4,在NH4HSO4溶液中加入NaOH使溶液呈中性,则溶液中各离子浓度大小顺序为C(Na+)>C(SO42-)>C(NH4+)>C(H+)=C(OH-).
3.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O(g)含有的分子数约为NA | |
| B. | 常温常压下,5.85g NaCl含有的Na+离子数为0.1 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| D. | 1L物质的量浓度为0.5mol•/L的CH3COOH溶液中,含有CH3COOH个数为0.5NA |
10.实验室用自来水制取蒸馏水可以采用的实验装置是( )
| A. |  | B. |  | ||
| C. | 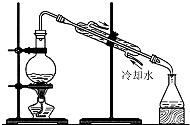 | D. | 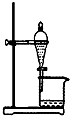 |