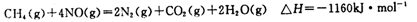题目内容
硝酸工业尾气中含有高浓度的NO和NO2,它们都是大气的重要污染物.已知某厂排放的尾气中NO、NO2的体积比为1:1,该厂采用NaOH溶液来处理该尾气,处理后所得溶液中只有一种含氮的钠盐.则该含氮的钠盐中,氮元素的化合价为( )
分析:NO、NO2的体积比为1:1,用NaOH溶液来处理该尾气,所得溶液中只有一种含氮的钠盐,根据氧化还原反应的特征可知,反应后的化合价应介于+2价和+4价之间,应为+3价.
解答:解:体积比为1:1的NO、NO2通入NaOH溶液中只生成一种产物,根据氧化还原反应的特征可知,反应后的化合价应介于+2价和+4价之间,应为+3价,发生反应的化学方程式为NO+NO2+2NaOH=2NaNO2+H2O,
故选C.
故选C.
点评:本题考查氮氧化物的性质,侧重于氧化还原反应的考查,注意把握氧化还原反应中元素化合价变化的特点,题目难度不大,该反应为归中反应.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
(08枣庄三诊)氨在国民经济中占有重要的地位。现在约有80%的氨用来制造化肥,其余的用作生产其他化工产品的原料。例如,农业上使用的氮肥如尿素、硝酸铵、磷酸铵、硫酸铵、氯化铵、氨水以及各种含氮混合肥料和复合肥料,都是以氨为原料制成的;氨氧化法制硝酸是工业上制硝酸的主要方法。
|
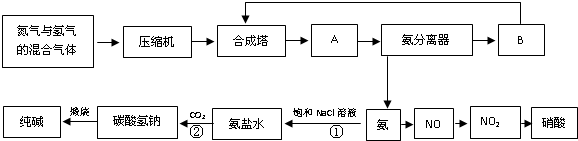
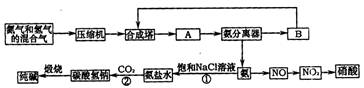
(1)下图是合成氨和利用氨制取硝酸、纯碱的简要流程示意图:
设备A的名称是 ,设备B的名称是 。
(2)硝酸厂的尾气中含有NO和NO2等污染物,籽了防止污染大气可以用纯碱溶液吸收从吸收塔中放出的尾气,发生的反应如下:Na2CO3+2NO2====NaNO2+NaNO3+CO2
但在实际生的中这种方法处理后尾气中的氮的氧化物含量仍难以降到排放标准,历此,也常利用各种燃料气中的甲烷等将氮的氧化物还原为空气主要成分而除去。写出甲烷与NO2反应的化学反应方程式: 。
(3)常压法生产出的硝酸浓度低,尾气中氮的氧化物含量高,对环境会有严重污染。可采用 法和 法进行改进。
(4)在纯碱制造过程中,过程①与过程②的顺序能否颠倒?为什么 。