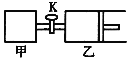
题目内容
【题目】X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系:
![]()
(1)若W为一种一元强碱,Y具有两性,X到Z的离子方程式为_____________。
(2)若X是一种黄绿色的气体,Y的饱和溶液滴入沸水中能生成红褐色胶体。
①检验溶液Z是否变质最灵敏的一种试剂是____________________(名称);
②Y与W转化为Z的离子反应方程式_________________________________;
③一定条件下W与水反应的化学方程式_______________________________。
(3)X常温下为气体化合物,Z是一种红棕色气体,X气体的检验方法____________________,X转化为Y的化学方程式为______________________;Z与水反应的过程中,氧化剂与还原剂的质量比为__________________。
(4)X为一元强碱溶液,W是形成酸雨的主要气体。
①则Y到Z的离子方程式为________________________________________;
②请画出向含0.01molX和0.01molY的溶液中逐滴加入0.1mol/L稀盐酸的体积和生成气体的物质的量的关系的图像___________。
【答案】Al3+ +4OH—= AlO2—+2H2O 硫氰化钾溶液 2Fe3+ + Fe === 3Fe2+ 3Fe + 4H2O(g) === Fe3O4 + 4H2 使湿润的红色石蕊试纸变蓝(或遇蘸有浓盐酸的玻璃棒产生白烟) 4NH3+5O2![]() 4NO+6H2O 1:2 SO32-+SO2+H2O=2HSO3-
4NO+6H2O 1:2 SO32-+SO2+H2O=2HSO3- 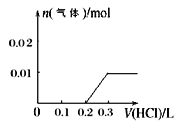
【解析】
)
(1)Y具有两性是突破点,得出Y为氢氧化铝,Z为偏铝酸盐,X为铝盐,写出离子方程式;
(2)X是一种黄绿色的气体,得出X为氯气,Y的饱和溶液滴入沸水中能生成红褐色胶体,得出Y为氯化铁,Z为氯化亚铁,W为铁;
(3)Z是一种红棕色气体,得出Z为NO2,逆推可得X为NH3,W为氧气,Y为NO;
(4)W是形成酸雨的主要气体,得出W为SO2,由于亚硫酸为二元酸,所以二氧化硫与强碱反应可以生成正盐与酸式盐,得出Y为亚硫酸钠,Z为亚硫酸氢钠。
(1)若W为一种一元强碱,Y为Al(OH)3,Z为偏铝酸盐,X为铝盐,X到Z的离子方程式为Al3+ +4OH—= AlO2—+2H2O。
正确答案:Al3+ +4OH—= AlO2—+2H2O;
(2)X是一种黄绿色的气体,得出X为氯气,Y的饱和溶液滴入沸水中能生成红褐色胶体,得出Y为氯化铁,Z为氯化亚铁,W为铁;
①亚铁离子容易被氧化为铁离子,检验变质最灵敏的试剂一般选特征反应,所以选择硫氰化钾溶液;
②氯化铁与铁转化为氯化亚铁的离子反应方程式2Fe3+ + Fe === 3Fe2+;
③一定条件下铁与水蒸汽可以反应的化学方程式3Fe + 4H2O(g) === Fe3O4 + 4H2。
正确答案:硫氰化钾溶液 2Fe3+ + Fe === 3Fe2+ 3Fe + 4H2O(g) === Fe3O4 + 4H2。
(3)Z是一种红棕色气体,得出Z为NO2,逆推可得X为NH3,W为氧气,Y为NO;NH3气体的检验方法是使湿润的红色石蕊试纸变蓝(或遇蘸有浓盐酸的玻璃棒产生白烟)NH3转化为NO的化学方程式为4NH3+5O2![]() 4NO+6H2O;NO2与水反应3NO2+H2O=2HNO3+NO,氧化剂与还原剂的均为NO2,质量比等于物质的量之比,根据化合价的变化,氧化剂升失氧,还原剂降得还,可得出氧化剂与还原剂的质量比为1:2;
4NO+6H2O;NO2与水反应3NO2+H2O=2HNO3+NO,氧化剂与还原剂的均为NO2,质量比等于物质的量之比,根据化合价的变化,氧化剂升失氧,还原剂降得还,可得出氧化剂与还原剂的质量比为1:2;
正确答案:使湿润的红色石蕊试纸变蓝(或遇蘸有浓盐酸的玻璃棒产生白烟) 4NH3+5O2![]() 4NO+6H2O 1:2 。
4NO+6H2O 1:2 。
(4)W是形成酸雨的主要气体,得出W为SO2,由于亚硫酸为二元酸,所以与强碱反应可以生成正盐与酸式盐,得出Y为亚硫酸钠,Z为亚硫酸氢钠;
①则亚硫酸钠到亚硫酸氢钠的离子方程式为SO32-+SO2+H2O=2HSO3- ;
②向含0.01mol一元强碱和0.01mol亚硫酸钠的溶液中逐滴加入0.1mol/L稀盐酸的体积和生成气体的物质的量的关系的图像分为三步:第一步:H++OH-=H2O;第二步:SO32- + H+= HSO3-;第三步:HSO3-+ H+= SO2+H2O,据此画出图像 ;
;
正确答案:

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案