题目内容
10.用蘸有浓氨水的棉棒对输氯管道检漏的原理为:3Cl2+8NH3$?_{高温、高压}^{催化剂}$N2+6NH4Cl.该反应的下列说法正确的是( )| A. | Cl2被氧化 | |
| B. | NH3得到电子 | |
| C. | Cl2是氧化剂 | |
| D. | 反应每生成1molN2转移电子数约为8×6.02×1023 |
分析 3Cl2+8NH3$?_{高温、高压}^{催化剂}$N2+6NH4Cl反应中,N元素的化合价由-3升高到0价,则NH3为还原剂,Cl元素的化合价由0降低到-1价,则Cl2为氧化剂,据此分析解答.
解答 解:A.3Cl2+8NH3$?_{高温、高压}^{催化剂}$N2+6NH4Cl反应中,Cl元素的化合价由0降低到-1价,则Cl2为氧化剂被还原,故A错误;
B.3Cl2+8NH3$?_{高温、高压}^{催化剂}$N2+6NH4Cl反应中,N元素的化合价由-3升高到0价,则NH3失去电子,故B错误;
C.3Cl2+8NH3$?_{高温、高压}^{催化剂}$N2+6NH4Cl反应中,Cl元素的化合价由0降低到-1价,则Cl2为氧化剂,故C正确;
D.3Cl2+8NH3$?_{高温、高压}^{催化剂}$N2+6NH4Cl反应中,N元素的化合价由-3升高到0价,则反应每生成1molN2转移电子数约为6×6.02×1023,故D错误;
故选C.
点评 本题考查氧化还原反应基本概念的判断等,为高频考点,把握反应中元素的化合价变化为解答的关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列叙述Ⅰ和Ⅱ均正确并且互为因果关系的是( )
| 选项 | 叙 述Ⅰ | 叙 述Ⅱ |
| A | NH3溶于水显碱性 | 用氨气作“喷泉实验” |
| B | 高锰酸钾具有强氧化性 | 高锰酸钾须与活性金属粉末分开储存 |
| C | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| D | 碘在酒精中溶解度大于在水中溶解度 | 用酒精萃取碘水中的碘 |
| A. | A | B. | B | C. | C | D. | D |
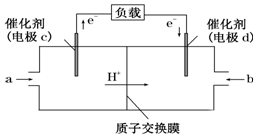
1. 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )| A. | 该装置将化学能转化为电能 | |
| B. | 电极b附近的pH值增大 | |
| C. | 电子迁移方向:电极a→灯泡→电极b→电解质溶液→电极a | |
| D. | 该电池的总反应:2H2+O2═2H2O |
2.下列关于化学用语的表述正确的是( )
| A. | 原子核内有10个中子的氧原子为816O | |
| B. | HClO的结构式为H-O-Cl | |
| C. | 乙烷的分子式为CH3CH3 | |
| D. | NH4Cl的电子式为 |
19.下列说法不正确的是( )
| A. | 硅晶体的导电性介于导体和绝缘体之间,常用作光导纤维 | |
| B. | BaSO4被称为重晶石,可用做“钡餐” | |
| C. | 氧化铁红颜料跟某些油料混合,可以制成防锈油漆 | |
| D. | 钠和钾的合金可用于快中子反应堆作热交换剂 |
1.绿色化学的最大特点在于它是在始端就采用实现污染预防的科学手段,因而过程和终端均为零排放或零污染.绿色化学主张在通过化学转换获取新物质的过程中充分利用每个原子,具有“原子经济性”,因此它既能够充分利用资源,又能够防止污染.下列化学反应,不符合绿色化学概念的是( )
| A. | 消除硫酸厂尾气排放 SO2+NH3+H2O═(NH4)2SO3 | |
| B. | 消除制硝酸工业尾气的氮氧化物污染 NO2+NO+NaOH═2NaNO2+H2O | |
| C. | 制CuSO4Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O | |
| D. | 制CuSO4 2Cu+O2═2CuO,CuO+H2SO4(稀)═CuSO4+H2O |


 .
. .
. .
. ),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):
),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件): .
.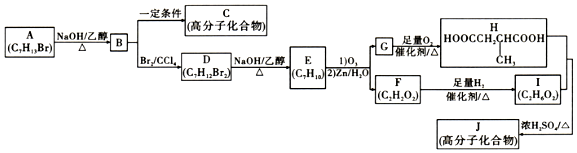
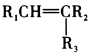 $→_{(2)Zn/H_{2}O}^{(1)O_{3}}$
$→_{(2)Zn/H_{2}O}^{(1)O_{3}}$
 .
. +(2n-1)H2O.
+(2n-1)H2O. .
. →
→ 的流程.(无机试剂及溶剂任选)
的流程.(无机试剂及溶剂任选)