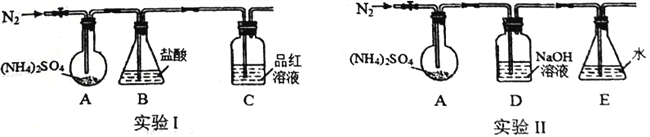
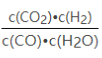��Ŀ����
����Ŀ�������£��� 20.0 g ��������Ϊ 14.0%�� KNO3��Һ�� 30.0 g ��������Ϊ 24.0%�� KNO3��Һ��ϣ��õ����ܶ�Ϊ1.15 g/cm3�Ļ����Һ�����㣺
��1����Ϻ���Һ����������_________��
��2����Ϻ���Һ�����ʵ���Ũ��_______��
��3����1000gˮ�����ܽ�______molKNO3����ʹ��Ũ��ǡ����������Ϻ���Һ��Ũ����ȣ�
��4�������44.8LHCl����ˮ���500mL��Һ�����㣺
��HCl�����ʵ���____________________��
��������Һ�����ʵ����ʵ���Ũ��____________________��
���𰸡�20%2.28mol/L2.482mol4mol/L
��������
��1����Ϻ���Һ�е�����Ϊ��20.0g+30.0g=50.0g����������ص�����Ϊ��20.0g��14%+30.0g��24%=10.0g����Ϻ���Һ������������![]() ��100%=20%���𣺻�Ϻ���Һ����������Ϊ20%��
��100%=20%���𣺻�Ϻ���Һ����������Ϊ20%��
��2�������Һ�����Ϊ��![]() =43.48mL=0.04348L����Һ�����ʵ����ʵ���Ϊ��
=43.48mL=0.04348L����Һ�����ʵ����ʵ���Ϊ��![]() =0.099mol����Ϻ���Һ�����ʵ���Ũ��Ϊ��
=0.099mol����Ϻ���Һ�����ʵ���Ũ��Ϊ��![]() =2.28mol/L���𣺻�Ϻ���Һ�����ʵ���Ũ��Ϊ2.28mol/L��
=2.28mol/L���𣺻�Ϻ���Һ�����ʵ���Ũ��Ϊ2.28mol/L��
��3������Ҫ����ص����ʵ���Ϊxmol������ص�����Ϊ101x�����ݣ�1����֪������ص���������Ϊ20%������=20%=![]() =
=![]() ��100%����ã�x��2.48mol������1 000gˮ�����ܽ�2.48molKNO3����ʹ��Ũ��ǡ����������Ϻ���Һ��Ũ�������
��100%����ã�x��2.48mol������1 000gˮ�����ܽ�2.48molKNO3����ʹ��Ũ��ǡ����������Ϻ���Һ��Ũ�������
��4���������44.8LHCl��n��HCl��=![]() =2mol����HCl�����ʵ���Ϊ2mol��
=2mol����HCl�����ʵ���Ϊ2mol��
�����500mL��Һ������Һ�����ʵ����ʵ���Ũ��c��HCl��=![]() =4mol/L������������Һ��HCl�����ʵ���Ũ��4mol/L��
=4mol/L������������Һ��HCl�����ʵ���Ũ��4mol/L��

����Ŀ����ˮCaCl2����ǿ�ҵ���ʪ�ԣ��ڿ������׳��⣬���������������ˮ���������������ȡ��Թ�ҵ̼��ƿ�ʯ����������SiO2 ��Fe2O3��Al2O3��FeCO3�����ʣ�������ˮ�Ȼ��Ƶ���Ҫ�������£�
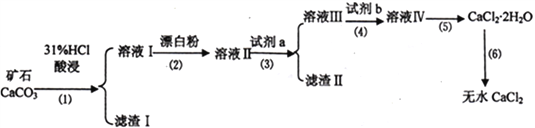
��1��Ϊ����߲��裨1���ķ�Ӧ���ʣ����Բ�ȡ�Ĵ�ʩ��________________________��
��2�������Լ�b ��Ŀ����ʹ��Һ�ữ���Լ�b ����ѡ�������Լ�__________������ţ���
������ ������ �������� ������
��3��д�����裨2�������ӷ���ʽ______________________________��
��4�����裨5���õ��IJ�������������Ũ����______________________________��
��5����֪A13+��Fe2+��Fe3+�����������������pH ���£�
Al (OH)3 | Fe(OH)2 | Fe(OH)3 | |||
��ʼ���� | 3.7 | ��ʼ�ܽ� | 7.8 | 6.5 | 1.5 |
������ȫ | 5.3 | ��ȫ�ܽ� | 10.0 | 9.7 | 3.3 |
�����Լ�a��Ŀ���ǵ�����Һ��pH������pH �ķ�ΧΪ_______________________________��
��6����֪ijһ�¶�ʱKsp[Fe(OH)3]=8.0��10-38����0.01 mol��L-1��FeCl3 ��Һ�м���NaOH ���壬������Һ��������䣬Ҫ����Fe(OH)3������Ӧʹ��Һ�е�c(OH-)��СΪ__________mol��L-1��Fe3+������ȫʱ����Һ��c(OH-) ��СΪ__________mol��L-1��
��7���ⶨ��Ʒ��Cl-�����ķ����ǣ�a.��ȡ0.7500g ��Ʒ���ܽ⣬��250mL ����ƿ�ж��ݣ�b.��ȡ25.00mL ����Һ����ƿ�У� c.��0.05000mol��L-1AgNO3 ��Һ�ζ����յ㣬����AgNO3��Һ�����ƽ��ֵΪ25.00mL������������Ʒ��CaCl2 ����������Ϊ________________________��