题目内容
【题目】常温下,向25 mL 0.1 mol·L-1弱碱MOH溶液中逐滴滴加0.2 mol·L-1的HCl,溶液pH的变化曲线如图所示(溶液混合时体积的变化忽略不计)。下列说法正确的是( )
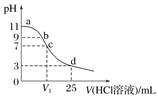
A. MOH电离方程式为MOH===M++OH-
B. 在b点,离子浓度大小为c(OH-)>c(H+)>c(M+)>c(Cl-)
C. 在c点,滴加的V(HCl)>12.5 mL
D. 在d点,c(Cl-)=2c(MOH)+2c(M+)=0.1 mol·L-1
【答案】D
【解析】A项,MOH是弱碱,电离方程式为MOH![]() M++OH-,A错误;B项,在b点,pH=9,溶质为MCl和MOH,离子浓度大小为c(M+)>c(Cl-) > c(OH-)>c(H+),B错误;C项,在c点,pH=7,因为MOH是弱碱,所以应为碱过量,盐酸不足,滴加的V(HCl)<12.5 mL,故C错误;D项,d点溶质为HCl和MCl,且物质的量之比为1:1,c(Cl-)= 0.1 mol·L-1,由物料守恒得:c(Cl-)=2c(MOH)+2c(M+)=0.1 mol·L-1,D正确。
M++OH-,A错误;B项,在b点,pH=9,溶质为MCl和MOH,离子浓度大小为c(M+)>c(Cl-) > c(OH-)>c(H+),B错误;C项,在c点,pH=7,因为MOH是弱碱,所以应为碱过量,盐酸不足,滴加的V(HCl)<12.5 mL,故C错误;D项,d点溶质为HCl和MCl,且物质的量之比为1:1,c(Cl-)= 0.1 mol·L-1,由物料守恒得:c(Cl-)=2c(MOH)+2c(M+)=0.1 mol·L-1,D正确。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】实验室用环己醇脱水的方法合成环己烯,该实验的装置如下图所示:

可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
按下列实验步骤回答问题:
Ⅰ.产物合成
在a中加入10.0g环己醇和2片碎瓷片,冷却搅拌下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度接近90℃。
(l)碎瓷片的作用是________;b的名称是________;
(2)a中发生主要反应的化学方程式为____________________________;本实验最容易产生的有机副产物的结构简式为________。
Ⅱ.分离提纯
将反应粗产物倒入分液漏斗中,依次用少量5%碳酸钠溶液和水洗涤,分离后加人无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过操作X得到纯净的环己烯,称量,其质量为4.1g。
(3)用碳酸钠溶液洗涤的作用是________,操作X的名称为________。
Ⅲ.产物分析及产率计算
(4)①核磁共振氢谱可以帮助鉴定产物是否为环己烯,环己烯分子中有_______种不同化学环境的氢原子。
② 本实验所得环己烯的产率是_______。

