题目内容
下列各组离子中,因发生氧化还原反应而不能大量共存的是
| A.K+、H+、I-、MnO4- | B.Fe3+、Fe2+、SO42-、NO3- |
| C.Al3+、Na+、SO42-、CO32- | D.Fe3+、H+、SO42-、ClO- |
A
解析试题分析:A I-在酸性条件下能被MnO4-氧化额不能存在。B离子间不会发生反应,能够共存。C.Al3+和CO32-会发生双水解反应而不能大量共存。D.次氯酸是弱酸,所以H+、ClO-不能大量共存。
考点:考查离子共存问题的知识。

练习册系列答案
相关题目
某溶液中存在较多的H+、SO42-、NO3-,则溶液中还可能大量存在的离子组是
| A.Mg2+、Ba2+、Br- | B.Al3+、CH3COO-、Cl- |
| C.Mg2+、Cl-、Fe2+ | D.Na+、NH4+、Cl- |
对下列离子组共存情况的判断正确的是 ( )
| A.使石蕊溶液变红的溶液中Fe2+、Cl-、NO3-、Na+能大量共存 |
| B.使酚酞溶液变红的溶液中Na+、AlO2-、NO3-、HCO3-能大量共存 |
| C.加入铝粉产生H2的溶液,可能存在大量的Na+、Ba2+、AlO2-、NO3- |
| D.含大量Fe3+的溶液中K+、NH4+、SO42-、SCN-能大量共存 |
水溶液X中只可能溶有K+、Mg2+、Al3+、[Al(OH)4]-、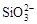 、
、 、
、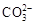 、
、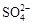 中的若干种离子。某同学对该溶液进行了如下实验:
中的若干种离子。某同学对该溶液进行了如下实验: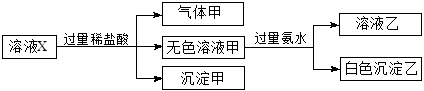
下列判断正确的是( )
| A.气体甲一定是纯净物 |
B.K+、[Al(OH)4]-和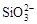 一定存在于溶液X中 一定存在于溶液X中 |
| C.沉淀甲是硅酸和硅酸镁的混合物 |
D.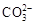 和 和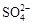 一定不存在于溶液X中 一定不存在于溶液X中 |
下列离子方程式书写正确的是( )
| A.氯化钡溶液中通入二氧化碳气体:Ba2++CO2+H2O=BaCO3↓+2H+ |
| B.次氯酸钙溶液中通人少量SO2气体:Ca2++2ClO一+SO2+H2O=CaSO3↓+2HClO |
| C.醋酸和碳酸氢钠溶液混合:CH3COOH+HCO3-=CO2↑+H2O+CH3COO- |
| D.碳酸氢镁溶液中加入过量石灰水: |
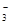 +Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓
+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓ 下列反应的离子方程式表示正确的是
| A.向MgCl2溶液中加入石灰乳:Mg2+ +2OH-= Mg(OH)2↓ |
| B.磁性氧化铁溶于稀硝酸:Fe3O4+8H+= Fe2++2Fe3++4H2O |
| C.向NaAlO2的水溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+ CO32- |
| D.向NaHCO3溶液中加入过量的澄清石灰水:HCO3-+Ca2++OH-=CaCO3↓+H2O |
常温下,下列各组离子在指定溶液中一定能大量共存的是:
| A.能使淀粉-KI试纸显蓝色的溶液中:K+ SO42- S2- SO32- |
| B.含有0.1mol·L-1 Fe2+的溶液:Na+Cl- ClO- SO42- |
| C.c(H+)/c(OH-)=1012的溶液中:Al3+ NH4+ NO3- K+ |
| D.含有0.1mol·L-1 HCO3-的溶液:Na+ Fe3+ NO3- C6H5O- |
在下列各溶液中,离子一定能大量共存的是( )
| A.强碱性溶液中:K+、Al3+、Cl-、SO42- |
B.含有0.1 mol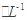 Fe3+的溶液中:K+、Mg2+、I-、NO3- Fe3+的溶液中:K+、Mg2+、I-、NO3- |
C.含有0.1mol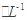 Ca2+溶液在中:Na+、K+、CO32-、Cl- Ca2+溶液在中:Na+、K+、CO32-、Cl- |
| D.室温下,pH=l的溶液中:Na+、Fe3+、NO3-、SO42- |