题目内容
【题目】铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质.
某化学小组在实验室中利用简易装置进行了铝和氧化铁的反应,发现生成的铁呈疏松多孔的褐色硬块.该小组成员认为主要原因是产生的铁中含有较多杂质,请你参与探究该褐色硬块的组成.
(1)首先将褐色硬块处理成粉末,通过实验来确定是否含有单质铝,经实验首先排除了铝的存在,则该小组成员在该实验中选用的试剂是 , 证明不含铝的实验现象为 .
(2)经初步确定后,可认为褐色硬块除Fe外,还含有Fe2O3、Al2O3 , 为验证其组成该小组设计如下流程: 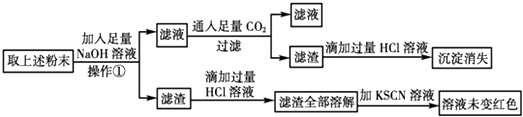
①在上述流程中,操作①所用到的玻璃仪器有 .
②通过上述实验该小组得出结论:该褐色硬块中除铁外,一定含有Al2O3 , 不含Fe2O3 , 你认为该结论是否可靠(填“是”或“否”),理由是(用离子方程式和必要的文字进行说明).
【答案】
(1)NaOH溶液;将粉末加入到NaOH溶液中,没有气体产生
(2)烧杯、玻璃棒、漏斗;否;通过该实验只能确定除铁外还含有Al2O3 , 无法确定是否含有Fe2O3 , 因经操作①得到的滤渣中含有大量的铁,即便是含有Fe2O3 , 在将滤渣溶于过量盐酸时发生反应:Fe2O3+6H+═3H2O+2Fe3+ , 2Fe3++Fe═3Fe2+ , 这样滤渣溶解后得到的溶液中也可能不含Fe3+ , 滴加KSCN溶液时溶液也不变红色
【解析】解:(1)金属铝可以和氢氧化钠发生反应产生氢气,所以可以取少量粉末加入NaOH溶液中,如果产生气泡证明含单质铝,反之则不含,所以答案是:NaOH溶液;将粉末加入到NaOH溶液中,没有气体产生;(2)氧化铝可以和氢氧化钠发生反应,生成偏铝酸钠溶液,和盐酸反应会出现白色沉淀,随着盐酸量的增多,沉淀消失,金属铁存在时可以将硫酸铜中的红色金属铜置换出来,氧化铁和盐酸反应后的溶液中,铁也可以和三价铁离子反应,遇到硫氰酸钾不显示红色,①在上述流程中,操作①是过滤操作,所用到的玻璃仪器为:烧杯、玻璃棒、漏斗;
所以答案是:烧杯、玻璃棒、漏斗; ②通过该实验只能确定除铁外还含有Al2O3 , 无法确定是否含有Fe2O3 , 因经操作①得到的滤渣中含有大量的铁,即便是含有Fe2O3 , 在将滤渣溶于过量盐酸时发生反应:Fe2O3+6H+═3H2O+2Fe3+ , 2Fe3++Fe═3Fe2+ , 这样滤渣溶解后得到的溶液中也可能不含Fe3+ , 滴加KSCN溶液时溶液也不变红色;所以答案是:否;通过该实验只能确定除铁外还含有Al2O3 , 无法确定是否含有Fe2O3 , 因经操作①得到的滤渣中含有大量的铁,即便是含有Fe2O3 , 在将滤渣溶于过量盐酸时发生反应:Fe2O3+6H+═3H2O+2Fe3+ , 2Fe3++Fe═3Fe2+ , 这样滤渣溶解后得到的溶液中也可能不含Fe3+ , 滴加KSCN溶液时溶液也不变红色.

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案【题目】表是元素周期表的一部分,其中每个数字序号代表一种短周期元素.
① | ||||||||
② | ③ | |||||||
④ | ⑤ | ⑥ | ||||||
请按要求回答下列问题:
(1)元素②在周期表中的位置为
(2)④、⑤两种元素相比较,金属性强的是(填元素符号);
(3)这些元素的最高价氧化物对应水化物中酸性最强的是(填化学式,下同),具有两性的是 .
(4)元素④和元素⑥形成的化合物的电子式为 .
(5)元素③和元素⑥的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式 .
【题目】下列实验操作能达到实验目的或得出相应结论的是
实 验 操 作 | 目的或结论 | |
A | 将Cu片放入FeCl3溶液中 | 证明Fe的金属性比Cu强 |
B | 将点燃的镁条置于盛有CO2的集气瓶中,瓶内壁有黑色固体生成 | 镁与CO2发生置换反应 |
C | 将SO2通入溴水或酸性高锰酸钾溶液中 | 证明SO2有漂白性 |
D | 向FeCl2溶液(含少量FeBr2杂质)中,加入适量氯水,再加CCl4萃取分液 | 除去FeCl2溶液中的FeBr2 |
A. A B. B C. C D. D