题目内容
【题目】NA代表阿伏加德罗常数,下列说法正确的是( )
A. 32克O2所含的原子数目为NA
B. 0.5molH2O含有的原子数目为1.5 NA
C. 常温常压下,11.2LCl2中含有的分子数为0.5NA
D. 标准状况下,22.4LH2O中含有的分子数为NA
【答案】B
【解析】
A、求出氧气的物质的量,然后根据原子个数N=2nNA来计算; B、1个水分子是由2个氢原子和1个氧原子构成; C、常温常压下气体摩尔体积大于22.4L/mol; D、标况下水为液态。
A、32克O2的物质的量为1mol,故原子个数为2NA个,所以A是错误的;B. 0.5molH2O含有的原子数目为0.5![]() 3NA=1.5NA,故B正确;C、常温常压下气体摩尔体积大于22.4L/mol,11.2LCl2的物质的量小于1mol,则分子个数小于NA个,故C错误;D、标况下水为液态,不能根据气体摩尔体积来计算其物质的量和分子个数,故D错误。所以答案为B。
3NA=1.5NA,故B正确;C、常温常压下气体摩尔体积大于22.4L/mol,11.2LCl2的物质的量小于1mol,则分子个数小于NA个,故C错误;D、标况下水为液态,不能根据气体摩尔体积来计算其物质的量和分子个数,故D错误。所以答案为B。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图1所示,A中放有浓硫酸,B中放有无水乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl26C2H5OH。
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
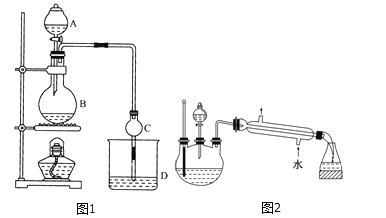
请回答:
(1)浓硫酸的作用是__________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:__________。
(2)球形干燥管C的作用是__________。若反应前向D中加入几滴酚酞,溶液呈红色,反应结束后D中的现象是__________。
(3)采用分液法从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,然后加入无水氯化钙,分离出__________;再加入无水硫酸钠除去水,然后进行__________(填操作名称),以得较纯净的乙酸乙酯。
(4)上述实验中饱和碳酸钠溶液的作用是______(填字母代号)。
A.反应掉乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出
D.加速酯的生成,提高其产率
(5)另一化学课外小组对上述实验进行了改进,设计了图2所示的装置,利用浓硫酸、乙醇、乙酸制取乙酸乙酯(铁架台、铁夹、加热装置均已略去)与图1所示装置相比,此装置的主要优点有(写出一条即可)__________。