题目内容
现有Na2CO3、H2SO4、Ba(OH)2三种物质的量浓度与体积都相等的溶液,若以不同顺序将它们中的两种混合起来,出现沉淀后过滤,再将滤液与第三种溶液混合起来,最终所得的溶液( )
| A、一定呈酸性 |
| B、可能呈碱性 |
| C、可能呈中性 |
| D、一定呈中性 |
考点:钠的重要化合物,化学基本反应类型,浓硫酸的性质
专题:元素及其化合物
分析:如果是Na2CO3、Ba(OH)2先混合,再把滤液和H2SO4混合,所得溶液为Na2SO4溶液,溶液显中性;如果是H2SO4、Ba(OH)2先混合,再与Na2CO3混合,得到的是Na2CO3溶液,溶液显碱性,如果是Na2CO3、H2SO4先混合,再把滤液和Ba(OH)2混合,所得溶液为NaOH溶液,呈碱性,以此解答.
解答:
解:若先将Na2CO3溶液和H2SO4溶液混合后,再加Ba(OH)2,Na2CO3、H2SO4恰好完全反应,生成的Na2SO4再与Ba(OH)2恰好完全反应,最终生成的NaOH溶液显碱性;
若先将Na2CO3溶液和Ba(OH)2溶液混合后,再加H2SO4,Na2CO3、Ba(OH)2恰好完全反应,生成的NaOH再与H2SO4恰好完全反应,最终生成的Na2SO4溶液显中性;
若先将H2SO4和Ba(OH)2溶液混合后,再加Na2CO3溶液,H2SO4和Ba(OH)2溶液恰好完全反应,生成硫酸钡和水,再加入a2CO3溶液,水解呈碱性.
则混合后溶液可能呈中性或碱性,不可能呈酸性,
故选BC.
若先将Na2CO3溶液和Ba(OH)2溶液混合后,再加H2SO4,Na2CO3、Ba(OH)2恰好完全反应,生成的NaOH再与H2SO4恰好完全反应,最终生成的Na2SO4溶液显中性;
若先将H2SO4和Ba(OH)2溶液混合后,再加Na2CO3溶液,H2SO4和Ba(OH)2溶液恰好完全反应,生成硫酸钡和水,再加入a2CO3溶液,水解呈碱性.
则混合后溶液可能呈中性或碱性,不可能呈酸性,
故选BC.
点评:本题综合考查元素化合物知识,为高频考点,侧重于学生的分析能力的考查,学生应考虑到不同顺序反应生成的物质能否再发生化学反应,判断最终溶液中的溶质来判断溶液的酸碱性,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列化学方程式或离子方程式正确的是( )
A、铁在少量氯气中燃烧:Fe+Cl2
| ||||
B、用两个铜电极电解食盐水:2Cl-+2H2O
| ||||
| C、亚硫酸钠固体溶于水:SO32-+H2O?HSO3-+OH- | ||||
| D、K37ClO3与浓盐酸(HCl)在加热时生成氯气:K37ClO3+6HCl═K37Cl+3Cl2↑+3H2O |
下列物质中,既能与盐酸反应又能与NaOH溶液反应的是( )
①Ca(HCO3)2 ②Al2O3 ③Al(OH)3 ④NaAlO2 ⑤(NH4)2S ⑥Al.
①Ca(HCO3)2 ②Al2O3 ③Al(OH)3 ④NaAlO2 ⑤(NH4)2S ⑥Al.
| A、②③ | B、②③⑥ |
| C、①②③⑤⑥ | D、全部 |
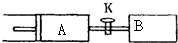 如图所示,向A、B中均充入1mol X、lmol Y,起始时A、B的体积都等于a L.在相同温度、外界压强和催化剂存在的条件下,关闭活塞K,使两容器中都发生下述反应:X(g)+Y(g)═2Z(g)+W(g)△H<0.达平衡时,A的体积为1.4a L.下列说法错误的是( )
如图所示,向A、B中均充入1mol X、lmol Y,起始时A、B的体积都等于a L.在相同温度、外界压强和催化剂存在的条件下,关闭活塞K,使两容器中都发生下述反应:X(g)+Y(g)═2Z(g)+W(g)△H<0.达平衡时,A的体积为1.4a L.下列说法错误的是( )| A、反应速率:v(B)>v(A) |
| B、A容器中X的转化率为80% |
| C、平衡时的压强:PB=PA |
| D、平衡时Y体积分数:A<B |
下列微粒在水溶液中能大量共存的是( )
| A、Fe3+、H+、I-、Na+ |
| B、Al3+、Na+、AlO2-、SO42- |
| C、K+、NH4+、H+、CO32- |
| D、Cu2+、SO42-、Al3+、Cl- |
下列与阿伏加德罗常数的值(NA)有关的说法正确的是( )
| A、NA个Fe(OH)3胶体粒子的质量为107g |
| B、3mol NF3与水完全反应生成HNO3和NO,转移电子数2NA |
| C、标准状况下,2.24L Cl2溶于水中达到饱和,可得到HClO分子的数目是0.1NA |
| D、常温常压下,1.7g H2O2中含有的电子数为NA |
可用Zn+Br2═ZnBr2 设计成蓄电池,其中负极反应是( )
| A、Zn→Zn2++2e- |
| B、Br2+2e-→2Br- |
| C、2Br→Br2+2e- |
| D、Zn2++2e-→Zn |
下列水解方程式正确的是( )
| A、Fe3++3H2O=Fe(OH)3↓+3H+ |
| B、Br-+H2O?HBr+OH- |
| C、CH3COOH+H2O?CH3COO-+H3O+ |
| D、NH4++2H2O?NH3?H2O+H3O+ |
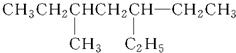 :
: :
: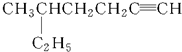
 :
: