题目内容
18.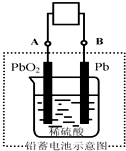 电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:2PbSO4+2H2O $?_{放电}^{充电}$Pb+PbO2+4H++2SO42-.则下列说法正确的是( )
电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:2PbSO4+2H2O $?_{放电}^{充电}$Pb+PbO2+4H++2SO42-.则下列说法正确的是( )| A. | 放电时:电子方向由B到A | |
| B. | 放电时:正极反应是 Pb-2e-+SO42-═PbSO4 | |
| C. | 充电时:阳极反应是PbSO4+2H2O-2e-═PbO2+SO42-+4H+ | |
| D. | 充电时:铅蓄电池的负极应与充电器电源的正极相连 |
分析 由铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O可知,放电时,Pb被氧化,应为电池负极反应,电极反应式为Pb-2e-+SO42-=PbSO4,正极上PbO2得电子被还原,电极反应式为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,在充电时,阳极上发生氧化反应,电极反应式和放电时的正极反应互为逆反应,阴极上发生还原反应,电极反应式和放电时的负极反应互为逆反应,
A.放电时,电流方向由正极经导线流向负极,电子流向与电流分析相反;
B.放电时,正极上得电子发生还原反应;
C.充电时,阳极上失电子发生氧化反应;
D.充电时,铅蓄电池的正极要恢复原状,则应该作电解池阳极,与电源正极相连.
解答 解:由铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O可知,放电时,Pb被氧化,应为电池负极反应,电极反应式为Pb-2e-+SO42-=PbSO4,正极上PbO2得电子被还原,电极反应式为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,在充电时,阳极上发生氧化反应,电极反应式和放电时的正极反应互为逆反应,阴极上发生还原反应,电极反应式和放电时的负极反应互为逆反应,
A.放电时,Pb极即B极为电池负极,PbO2极即A极为正极,电子由负极经导线流向正极,即由B经导线流向A,故A正确;
B.放电时,正极上二氧化铅得电子和硫酸根离子反应生成硫酸铅,电极反应式为PbO2+2e-+SO42-=PbSO4,故B错误;
C.充电时,阳极上电极反应式为PbSO4-2e-+2H2O=PbO2+SO42-+4H+,故C正确;
D.在充电时,铅蓄电池的正极的逆反应是氧化反应,应与充电器电源的正极相连,故D错误;
故选AC.
点评 本题考查了原电池和电解池原理,明确正负极、阴阳极上得失电子及电极反应是解本题关键,难点是电极反应式的书写,注意原电池正负极上发生的反应为电解池阳极、阴极上发生反应的逆反应,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 铁与稀硫酸反应制取H2后的溶液中:Na+、K+、AlO2-、Br- | |
| B. | 银氨溶液:Na+、K+、NO3-、NH3•H2O | |
| C. | 苯酚钠溶液:H+、HCO3-、SO2、K+ | |
| D. | 氢氧化铝胶体:H+、K+、S2-、SO32- |
| A. | 家用电器起火 常用液态CO2灭火 一般不用液态四氯化碳 | |
| B. | 将一氧化碳中毒者移到通风处抢救 | |
| C. | 眼睛里不慎溅进了药液 应立即用水冲洗 边洗边眨眼睛 不可用手揉眼睛 | |
| D. | 实验后 剩余的药品不能随便丢弃 或浪费 应放回原瓶 |


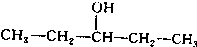 .
.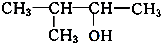 、
、 写出另外两种同分异构体的结构简式:
写出另外两种同分异构体的结构简式: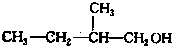 、
、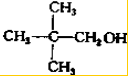 .
.