��Ŀ����
����Ŀ��ij��Һ���ܺ���Cl����SO42����CO32����HCO3����NH4+��Fe3+��Ba2+��K+ �� ȡ����Һ100mL���������NaOH��Һ���ȣ��õ�0.02mol���壬ͬʱ����1.97g��ɫ��������������Һ�м�����BaCl2��Һ��Ҳ�õ�1.97g�������ɴ˿�֪ԭ��Һ�У� ��
A.���ٴ���5������
B.Cl��һ�����ڣ���c��Cl������0.2mol/L
C.SO42����NH4+��Fe3+һ�����ڣ�Al3+��K+��Cl�����ܴ���
D.CO32��һ�������ڣ�SO42����NH4+��Fe3+��Cl��һ������
���𰸡�B
���������⣺ij��Һ���ܺ���Cl����SO42����CO32����HCO3����NH4+��Fe3+��Ba2+��K+ �� ȡ����Һ100mL���������NaOH��Һ���ȣ��õ�0.02mol���壬�ж�Ϊ������NH4++OH��=NH3��+H2O����Һ��һ����NH4+ �� ���ʵ���Ϊ0.02mol��ͬʱ����1.97g��ɫ������������֪��Һ��һ����Ba2+ �� ��һ������SO42����CO32����Fe3+ �� ��ɫ����ΪBaCO3 �� ��̼��������Ӻ��������Ʒ�Ӧ����̼������ӽ�ϱ��������ɵ�̼�ᱵ��ɫ��������������Һ�м�����BaCl2��Һ��Ҳ�õ�1.97g������̼�ᱵ��������̼������������ʵ���= ![]() +
+ ![]() =0.02mol��ԭ��Һ��Ba2+���ʵ���=
=0.02mol��ԭ��Һ��Ba2+���ʵ���= ![]() =0.01mol�������Һ�е���غ�����ж����������Ƿ���ڣ������ӣ�n��NH4+��+2n��Ba2+��=0.02mol+2��0.02mol=0.06mol��n��HCO3����=0.02mol����һ����Cl�����ʵ�������Ϊ0.02mol��K+���ܺ��У�
=0.01mol�������Һ�е���غ�����ж����������Ƿ���ڣ������ӣ�n��NH4+��+2n��Ba2+��=0.02mol+2��0.02mol=0.06mol��n��HCO3����=0.02mol����һ����Cl�����ʵ�������Ϊ0.02mol��K+���ܺ��У�
A��������֪һ�����е�����HCO3����NH4+��Ba2+��Cl�� �� ���ܺ�K+ �� ������Һ�����ٴ���4�����ӣ���A����
B��������Һ�е�ɷ�����֪�������ӣ�n��NH4+��+2n��Ba2+��=0.02mol+2��0.02mol=0.06mol��n��HCO3����=0.02mol����һ����Cl�����ʵ�������Ϊ0.02mol��Cl��һ�����ڣ�K+���ӿ��ܺ��У�������Ũ������Ϊ��c��Cl������ ![]() =0.2mol/L����B��ȷ��
=0.2mol/L����B��ȷ��
C��SO42����Fe3+һ�������ڣ�K+��Cl�����ܴ��ڣ�NH4+һ�����ڣ���C����
D��CO32��һ�������ڣ�HCO3����NH4+��Ba2+��Cl��һ�����ڣ�SO42����Fe3+һ�������ڣ���D����
��ѡB��
ij��Һ���ܺ���Cl����SO42����CO32����HCO3����NH4+��Fe3+��Ba2+��K+ �� ȡ����Һ100mL���������NaOH��Һ���ȣ��õ�0.02mol���壬�ж�Ϊ������NH4++OH��=NH3��+H2O����Һ��һ����NH4+ �� ���ʵ���Ϊ0.02mol��ͬʱ����1.97g��ɫ������������֪��Һ��һ����Ba2+ �� ��һ������SO42����CO32����Fe3+ �� ��ɫ����ΪBaCO3 �� ��̼��������Ӻ��������Ʒ�Ӧ����̼������ӽ�ϱ��������ɵ�̼�ᱵ��ɫ��������������Һ�м�����BaCl2��Һ��Ҳ�õ�1.97g������̼�ᱵ��������̼������������ʵ���= ![]() +
+ ![]() =0.02mol��ԭ��Һ��Ba2+���ʵ���=
=0.02mol��ԭ��Һ��Ba2+���ʵ���= ![]() =0.01mol�������Һ�е���غ�����ж����������Ƿ���ڣ������ӣ�n��NH4+��+2n��Ba2+��=0.02mol+2��0.02mol=0.06mol��n��HCO3����=0.02mol����һ����Cl�����ʵ�������Ϊ0.02mol��K+���ܺ��У�����ѡ������жϣ�
=0.01mol�������Һ�е���غ�����ж����������Ƿ���ڣ������ӣ�n��NH4+��+2n��Ba2+��=0.02mol+2��0.02mol=0.06mol��n��HCO3����=0.02mol����һ����Cl�����ʵ�������Ϊ0.02mol��K+���ܺ��У�����ѡ������жϣ�

 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д�����Ŀ�����������NOx���Ǵ�����Ⱦ��֮һ����ҵ����һ���¶Ⱥʹ�����������NH3��NOx��ԭ����N2 �� ijͬѧ��ʵ�����ж�NH3��NOx��Ӧ������̽�����ռ�����NH3����ע����X�У�Ӳ�ʲ�����Y�м�����������������NO2�������ü���K1��K2�кã�����һ���¶��°�ͼʾװ�ý���ʵ�飮 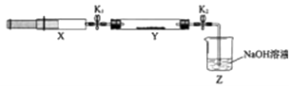
�������� | ʵ������ | ����ԭ�� |
��K1 �� �ƶ�ע����������ʹX�е����建��ͨ��Y���� | ��Y���� | �ڷ�Ӧ�Ļ�ѧ����ʽ |
��ע���������˻�ԭ�����̶�����װ�ûָ������� | Y����������ˮ�� | ���ɵ���̬ˮ���� |
��K2 | �� | �� |
