题目内容
【题目】下列有关阿伏加德罗常数NA的说法正确的是( )
A. 标准状况下,5.6 L CO2与足量Na2O2反应转移的电子数为0.5NA
B. 常温常压下,11gCO2中含有0.75NA个原子
C. 标准状况下,NA个水分子的体积约为22.4L
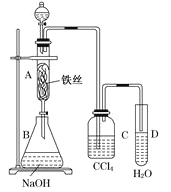
D. 50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
【答案】B
【解析】
A. 求出二氧化碳的物质的量,然后根据过氧化钠和二氧化碳的反应为歧化反应来分析;
B. 根据公式n = ![]() 计算出CO2的物质的量,再结合分子构成得出结论;
计算出CO2的物质的量,再结合分子构成得出结论;
C. 标况下水为液体,不能用气体摩尔体积计算;
D. 二氧化锰只能和浓盐酸反应,和稀盐酸不反应。
A. 标准状况下5.6 L二氧化碳的物质的量为![]() = 0.25 mol,而过氧化钠和二氧化碳的反应为歧化反应,根据关系式2CO2
= 0.25 mol,而过氧化钠和二氧化碳的反应为歧化反应,根据关系式2CO2![]() 2e-可知,当0.25 mol二氧化碳参与反应后,转移0.25 NA个电子,故A项错误;
2e-可知,当0.25 mol二氧化碳参与反应后,转移0.25 NA个电子,故A项错误;
B. 11 g CO2的物质的量为![]() = 0.25 mol,则其分子内原子个数为0.25 mol
= 0.25 mol,则其分子内原子个数为0.25 mol![]() 3
3![]() NA= 0.75 NA,故B项正确;
NA= 0.75 NA,故B项正确;
C. 标准状况下水为液体,条件不足,不能按气体摩尔体积22.4 L/mol计算水的体积,故C项错误;
D. 浓盐酸与MnO2共热产生氯气,但随着反应的进行,浓盐酸会变稀,稀盐酸不与MnO2反应,即给定的盐酸不能反应完全,故转移的电子数小于0.3 NA,故D项错误;
答案选B。

 作业辅导系列答案
作业辅导系列答案【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A | B | C | D | |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | Na2S溶液滴入AgCl浊液中 | 热铜丝插入稀硝酸中 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 沉淀由白色逐渐变为黑色 | 产生无色气体,随后变为红棕色 |
A. A B. B C. C D. D
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 溴乙烷与氢氧化钠乙醇溶液共热,生成气体通入酸性高锰酸钾溶液中,褪色 | 有乙烯生成 |
B | 向试管中的浓硫酸加入铜片,盖好胶塞,导管通气入品红溶液,无明显现象 | 铜片未打磨 |
C | 除去CuSO4溶液中Fe2+:先加足量H2O2,再加Cu(OH)2调溶液pH=4 | Ksp[Cu(OH)2]>Ksp[Fe(OH)2] |
D | 将有色纸条放入盛满干燥氯气的集气瓶中,盖上玻璃片,无明显现象 | 氯气漂白不是Cl2分子直接作用的结果 |
A. A B. B C. C D. D